
| A、SO2 |
| B、NO3- |
| C、Fe3+ |
| D、Fe2+ |


科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-] |
| B、0.1 mol?L-1Na2S溶液中:2[Na+]=[S2-]+[HS-]+[H2S] |
| C、0.1 mol?L-1 NaHCO3溶液中:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-] |
| D、等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸乙酯水解,加入氢氧化钠溶液 |
| B、苯与液溴反应,加入少量铁粉 |
| C、实验室制取甲烷时,加入生石灰 |
| D、锌与盐酸反应,加入少量浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
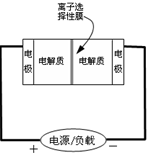 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3| 放电 |
| 充电 |
| A、放电过程中钠离子从左到右通过离子交换膜 |
| B、电池放电时,负极反应为:3NaBr-2e-=NaBr3+2Na+ |
| C、充电过程中钠离子在右边电极区域放电 |
| D、充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3是氧化剂,H2O是还原剂 |
| B、NF3在潮湿空气中泄漏会看到红棕色气体 |
| C、每消耗0.2mol氧化剂,可收集到5.418L气体 |
| D、若生成1molHNO3,则转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B、上述反应中,每生成1 molAlN需转移3 mol电子 |
| C、AlN中氮元素的化合价为+3 |
| D、AlN的摩尔质量为41g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、σ键不属于共价键 |
| B、s-sσ键与s-pσ键都是轴对称 |
| C、分子中含有共价键,则至少含有一个σ键 |
| D、含有π键的化合物与只含σ键的化合物的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com