
ÉčNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
| A£®5.6 g FeÓė×ćĮæĻ”HNO3·¢Éś·“Ó¦£¬×ŖŅʵĵē×ÓŹżĪŖ0.3 NA |
| B£®ŌŚ1 L 0.1 mol/L AlCl3ČÜŅŗÖŠŗ¬ÓŠ0.1 NAøöAl3+ |
| C£®ŌŚÄ³ĆܱÕČŻĘ÷ÖŠŹ¢ÓŠ0.1 mol N2ŗĶ0.3 mol H2£¬ŌŚŅ»¶ØĢõ¼žĻĀ³ä·Ö·“Ó¦ŗó£¬æɵĆ0.2 NAøöNH3·Ö×Ó |
| D£®±ź×¼×“æöĻĀ£¬11.2 LĖÄĀČ»ÆĢ¼ÖŠŗ¬ÓŠµÄC”ŖCl¼üµÄøöŹżĪŖ2 NA |
A
½āĪöŹŌĢā·ÖĪö£ŗA”¢FeÓė×ćĮæĻ”HNO3·¢Éś·“Ó¦£¬Éś³ÉÕżČż¼ŪµÄĢśĄė×Ó£¬ÕżČ·£»B”¢ĀĮĄė×Ó»į·¢ÉśĖ®½ā£¬Ņņ“ĖŌŚ1 L 0.1 mol/L AlCl3ČÜŅŗÖŠŗ¬ÓŠŠ”ÓŚ0.1 NAøöAl3+£¬“ķĪó£»D”¢ÕāŹĒøöæÉÄę·“Ó¦£¬²»æÉÄܽųŠŠµ½µ×£¬“ķĪó£»D”¢±ź×¼×“æöĻĀ£¬ĖÄĀČ»ÆĢ¼ŹĒŅŗĢ壬²»ÄÜŹ¹ÓĆ22.4L/mol£¬“ķĪó”£
æ¼µć£ŗŃõ»Æ»¹Ō”¢Ė®½ā”¢Ę½ŗāµČÓŠ¹ŲÖŖŹ¶”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
æĘѧ¼ŅŅŃ·¢ĻÖŅ»ÖÖŠĀŠĶĒā·Ö×Ó£¬Ęä»ÆѧŹ½ĪŖH3£¬ŌŚĻąĶ¬Ģõ¼žĻĀ£¬µČÖŹĮæµÄH3ŗĶH2ĻąĶ¬µÄŹĒ£Ø £©
| A£®Ō×ÓŹż | B£®·Ö×ÓŹż | C£®Ģå»ż | D£®ĪļÖŹµÄĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
Ć¾ŗĶĀĮ·Ö±šÓėµČÅØ¶Č”¢µČĢå»żµÄ¹żĮæĻ”ĮņĖį·“Ó¦£¬²śÉśĘųĢåµÄĢå»ż(V)ÓėŹ±¼ä(t)¹ŲĻµČēĶ¼”£·“Ó¦ÖŠĆ¾ŗĶĀĮµÄ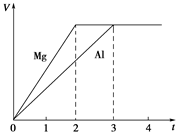
| A£®ĪļÖŹµÄĮæÖ®±ČĪŖ3”Ć2 |
| B£®ÖŹĮæÖ®±ČĪŖ3”Ć2 |
| C£®Ä¦¶ūÖŹĮæÖ®±ČĪŖ2”Ć3 |
| D£®·“Ó¦ĖŁĀŹÖ®±ČĪŖ2”Ć3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
¹żŃõ»ÆøĘ£ØCaO2£©ŹĒŅ»ÖÖ°²Č«ĪŽ¶¾ĪļÖŹ£¬“ųÓŠŹżĮæ²»µČµÄ½į¾§Ė®£¬Ķس£»¹ŗ¬²æ·ÖCaO”£ŅŃÖŖ£ŗ2CaO2”¤nH2O 2CaO+O2”ü+2nH2O£¬2CaO2+4HCl£½2CaCl2+2H2O+O2”ü”£ĻÖ³ĘČ”2.168 g¹żŃõ»ÆøĘѳʷ·Ö³ÉĮ½µČ·Ż½ųŠŠĻĀĮŠŹµŃé£ŗ
2CaO+O2”ü+2nH2O£¬2CaO2+4HCl£½2CaCl2+2H2O+O2”ü”£ĻÖ³ĘČ”2.168 g¹żŃõ»ÆøĘѳʷ·Ö³ÉĮ½µČ·Ż½ųŠŠĻĀĮŠŹµŃé£ŗ
ŹµŃéŅ»£ŗ½«Ņ»·Ż¹żŃõ»ÆøĘѳʷ³ä·Ö×ĘČČ£¬½į¹ūµĆµ½µÄO2ŌŚ±ź×¼×“æöĻĀĢå»żĪŖ134.4 mL”£
ŹµŃ鶞£ŗ½«ĮķŅ»·ŻŃłĘ·ČÜÓŚŹŹĮæµÄĻ”ŃĪĖįÖŠ£¬³ä·Ö·“Ó¦ŗ󣬼ÓČė×ćĮæµÄNa2CO3ČÜŅŗ£¬½į¹ūµĆµ½1.40 g³Įµķ”£
£Ø1£©ŹŌ¼ĘĖć2.168 gѳʷ֊CaOµÄÖŹĮæ.
£Ø2£©ŹŌ¼ĘĖćѳʷ֊CaO2”¤nH2OµÄnÖµ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
Ķłŗ¬I£ŗĶCl£µÄĻ”ČÜŅŗÖŠµĪČėAgNO3ČÜŅŗ£¬³ĮµķµÄÖŹĮæÓė¼ÓČėAgNO3ČÜŅŗĢå»żµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ŌņŌČÜŅŗÖŠc(I£)/c(Cl£)µÄ±ČÖµĪŖ( ) 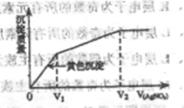
| A£®(V2£V1)V1 | B£®V1/V2 |
| C£®V1/(V2£V1) | D£®V2/V1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŅŌNA±ķŹ¾°¢·üŁ¤µĀĀŽ³£ŹżµÄŹżÖµ£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
| A£®1 L1mol/L H2SO4£¬ŗ¬ÓŠ2NAøöH+ |
| B£®500mL2mol/LŃĪĖį±Č100mL2mol/LĮņĖįµÄµ¼µēŠŌĒæ |
| C£®1mol Na2S2£¬ŗ¬NAøö¹²¼Ū¼ü |
| D£®±ź×¼×“æöĻĀ£¬3£®36 LSO2µÄÖŹĮæŌ¼ĪŖ9£®6g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠŠšŹöÖŠ²»ÕżČ·µÄŹĒ
| A£®16. 9 g¹żĀČ»Æ±µ(BaO2)¹ĢĢåÖŠŅõ”¢ŃōĄė×Ó×ÜŹżŌ¼ĪŖ0. 2NA |
| B£®³£ĪĀ³£Ń¹ĻĀ£¬28 gŅŅĻ©ŗĶ»·¶”Ķé(C4H8)µÄ»ģŗĻĘųĢåÖŠŗ¬ÓŠµÄĢ¼Ō×ÓŹżĪŖ2 NA |
| C£®a gijĘųĢåŗ¬·Ö×ÓŹżĪŖb£¬c gøĆĘųĢåŌŚ±źæöĻĀµÄĢå»żĪŖ22. 4bc/ aNAL |
| D£®Ä³ĆܱÕČŻĘ÷Ź¢ÓŠ0. l molN2ŗĶ0. 3 mol H2£¬ŌŚŅ»¶ØĢõ¼žĻĀ³ä·Ö·“Ó¦£¬×ŖŅʵē×ӵďżÄæĪŖ0. 6NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
| A£®1mol Na2O2¹ĢĢåÖŠŗ¬ÓŠO22£2 NA |
| B£®³£ĪĀ³£Ń¹ĻĀ£¬3.2 g CH4ÖŠŗ¬ÓŠµē×Ó2 NA |
| C£®±ź×¼×“æöĻĀ£¬11.2 L CH3CH2OHÖŠŗ¬ÓŠ·Ö×Ó0.5NA |
| D£®100 mL 1 mol”¤L-1µÄCH3COOHČÜŅŗÖŠŗ¬ÓŠCH3COOH·Ö×Ó0.1 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ĻĀĮŠ»ÆѧÓĆÓļÕżČ·µÄŹĒ
A£®ĀĮĄė×ӵĽį¹¹Ź¾ŅāĶ¼£ŗ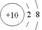 | B£®CaH2µÄµē×ÓŹ½£ŗ[H:]?Ca2+[:H]- |
C£®CO2µÄ±ČĄżÄ£ŠĶ£ŗ  | D£®ŗĖÄŚÓŠ8øöÖŠ×ÓµÄĢ¼Ō×Ó£ŗ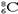 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com