
人体血液里存在重要的酸碱平衡: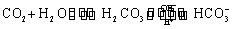 使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随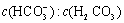 变化关系如下表:
变化关系如下表:
|
| 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.4 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO3-的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO3-)
D.pH=7.40的血液中,HCO3-的水解程度一定大于H2CO3的电离程度
【知识点】弱电解质在水溶液中的电离
【答案解析】D 解析:A、人体血液pH小于7.35时碳酸会转化成碳酸氢根,使酸性降低,当人体血液pH大于7.45,碳酸氢根会转化成碳酸增大酸度,所以正常人体血液中,HCO3-的水解程度大于电离程度,故A正确;
B、人体血液酸中毒时,只要增加碳酸氢根即可缓解,所以可注射NaHCO3溶液当然可以缓解酸中毒,故B正确;
C、从pH随c(HCO3-):c(H2CO3)变化关系表知,pH=7.00的血液中,c(H2CO3)<c(HCO3-),故C正确;
D、pH=7.40的血液中,c(HCO3-):c(H2CO3)=20.0,只能说明血液中的HCO3-远大于H2CO3但并不能说明HCO3-的水解程度一定大于H2CO3的电离程度,所以D错误;
故答案选D
【思路点拨】本题综合考查根据信息分析平衡问题的能力,难度中等。


科目:高中化学 来源: 题型:
氨与硝酸在工农业生产中均有重要的用途。某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g)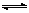 2NH3(g) △H<0
2NH3(g) △H<0
①一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原的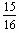 ,则N2的转化率α= ;若此时放出热量为aKJ,则其热化学方程式为 ___________________。
,则N2的转化率α= ;若此时放出热量为aKJ,则其热化学方程式为 ___________________。
②氨气溶于水则为氨水。已知NH3·H2O的电离平衡常数为Kb,计算0.1mol/L的NH3·H2O溶液中c(OH-)=___________mol/L(设平衡时NH3·H2O的浓度约为0.1mol/L,用含有Kb的代数式表示)。
(2)以氨气、空气为主要原料先进行氨的催化氧化,然后制得硝酸。
①其中NO在容积恒定的密闭容器中进行反应:
2NO(g)+O2(g)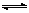 2NO2(g) △H>0
2NO2(g) △H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。
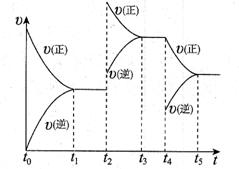
a.在t1~t2时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时与在t1~t2时的平衡常数K肯定相同
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
②实际上,生成的NO2会聚合生成N2O4。如果在一密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)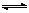 N2O4(g) △H<0的平衡常数K=13.3。若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol/L,c(N2O4)=0.007mol/L,则改变的条件是 。
N2O4(g) △H<0的平衡常数K=13.3。若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol/L,c(N2O4)=0.007mol/L,则改变的条件是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.常温下, 0.1 mol/L氨水(电离度α=1%)的pH为11:
C.用蒸馏水润湿的试纸测溶液的pH,不一定会使结果偏低
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.05 mol NaOH固体分别加入到下列100 mL溶液中,导电能力变化较大的是( )
A.0.5 mol/L的CH3COOH溶液 B.0.5 mol/L盐酸
C.0.5 mol/LCuSO4溶液 D.0.5 mol/L NH4NO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
CH4 (g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-570 kJ·mol-1
CH4(g)+4NO(g)===2 N2(g) +CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
请写出CH4 与NO2生成无毒气体的热化学方程式:
_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
| 化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0. 80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
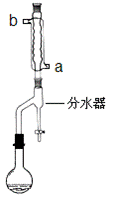 (一)乙酸正丁酯的制备
(一)乙酸正丁酯的制备
①在干燥的50mL圆底烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10 mL的水洗涤。有机层继续用10 mL10%Na2CO3洗涤至中性,再用10 mL 的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥。
③将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集125~127 ℃的馏分,得11.6 g乙酸正丁酯
请回答有关问题。
(1)冷水应该从冷凝管 ___________(填a或b)管口通入。
(2)步骤①中不断从分水器下部分出生成的水的目的是_________________________
步骤①中判断反应终点的依据是_____________________________________。
 (3)产品的精制过程步骤②中,第一次水洗的目的是_____________________________,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是_________________________________。
(3)产品的精制过程步骤②中,第一次水洗的目的是_____________________________,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是_________________________________。
(4)下列关于分液漏斗的使用叙述正确的是____
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的2/3
C.萃取振荡操作应如右图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(5)步骤③的常压蒸馏,需收集126℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是_________________________
(6)该实验过程中,生成乙酸正丁酯(式量116)的产率是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习兴趣小组讨论辨析以下说法,其中说法正确的是( )
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物
A.③⑤⑥ B.①② C.③⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
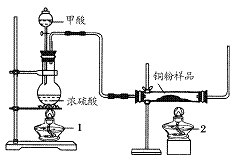
(1)制备一氧化碳的化学方程式是___________________。
(2)实验中,观察到反应管中发生的现象是_____________;尾气的主要成分是_________。
(3)反应完成后,正确的操作顺序为________(填字母)
a.关闭漏斗开关 b.熄灭酒精灯1 c.熄灭酒精灯2
(4)若实验中称取铜粉样品10.0 g,充分反应后,反应管中剩余固体的质量为9.6 g,则原样品中单质铜的质量分数为________。
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的最佳方案:
①设计方案的主要步骤是(不必描述操作过程的细节)__________;
②写出有关反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属锂是密度最小的金属,等质量的金属锂能释放出更多的电子,故常用来制造高能量电池。已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是( )
A.电解法 B.热还原性 C.热分解性 D.铝热法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com