
| A. |  | B. | 26M3+ | C. |  | D. | CH3COONa |
分析 水的电离方程式为H2O═H++OH-,加入酸或碱能抑制水的电离,加入含有弱根离子的盐能促进水的电离,强酸强碱盐不影响水的电离,以此解答该题.
解答 解:A.氯化氢溶于水后能电离出氢离子,使水的电离向左移动,所以能抑制水的电离,故A不选;
B.26M3+为26Fe3+,Fe3+能结合水电离的氢氧根离子生成弱电解质,使水的电离向正移,所以促进水的电离,故B不选;
C. 为Cl-,加入Cl-后,对水的电离平衡没有影响,平衡不移动,故C选;
为Cl-,加入Cl-后,对水的电离平衡没有影响,平衡不移动,故C选;
D.加入了CH3COO-,CH3COO- 会结合H+,c(H+)减小,平衡向右移动,故D不选.
故选C.
点评 本题考查了水的电离,影响水的电离的因素有:温度、酸碱、含有弱根离子的盐,酸或碱能抑制水的电离,含有弱根离子的盐能促进水的电离,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O3和O2互为同位素 | |
| B. | O3与O2的相互转变是物理变化 | |
| C. | 相同状况下,等体积O3和O2含有相同质子数 | |
| D. | O3比O2氧化性更强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | ||||
| Y | Z | W |
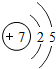 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | ①能使溴的四氯化碳溶液褪色 ②比例模型为 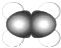 ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成 ②球棍模型为 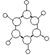 |
| C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
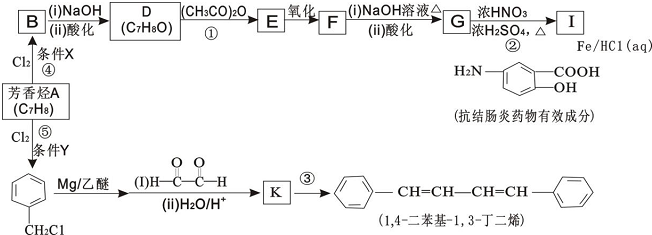
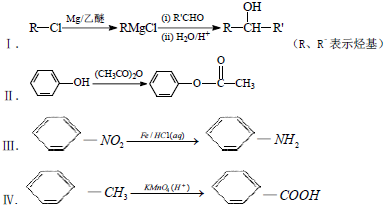

 .
.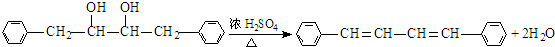 .
.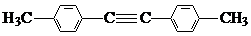 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cr2O72-和CrO42-的浓度相同 | B. | 2v正(Cr2O72-)=v逆(CrO42-) | ||
| C. | 溶液的颜色不变 | D. | 溶液的pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com