
| ��� | �¶�/K | ��Ӧʱ��/h | ��Ӧ�����ʵ������ | ʵ��Ŀ�� |
| �� | 378 | 3 | 3��1 | ʵ��ں͢�̽���¶ȶԲ��ʵ�Ӱ�� ʵ��ں͢�̽����Ӧʱ��Բ��ʵ�Ӱ�� |
| �� | 378 | 4 | 4��1 | |
| �� | 378 | 3 | 4��1 | |
| �� | 398 | 4 | 4��1 |
���� ��1���ɡ�H=��Ӧ��ļ���-������ļ��ܽ��
��2�������Ȼ�ѧ����ʽ����дԭ��д������ȼ��������̬ˮ���Ȼ�ѧ����ʽ����д��������NO��O2��Ӧ����1molNO2���ʱ�Ϊ-57.07KJ��1molNO2��H2O��Ӧ����HNO3��Һ��NO���ʱ�Ϊ-46KJ���Ȼ�ѧ����ʽ����ϸ�˹���ɼ���õ������Ȼ�ѧ����ʽ��
��3����ˮ�е������������Ũ�Ⱥ�����������Ũ����ͬ��PH=-lgc��H+�����¶Ȳ���Kw���䣬ij�¶��´�ˮ�е�c��H+��=2��10-7mol/L��Kw=2��10-7mol/L��2��10-7mol/L=4��10-14��mol/L��2��Kw=c��H+��c��OH-������õ���
��4��ʵ����ݿ��Ʊ��������жԱ����飬�о��¶ȡ���Ӧʱ�䡢��Ӧ����ȶ�����þ���ʵ�Ӱ�죬���ݿ��Ʊ��������жԱ����飬�о��¶ȡ���Ӧʱ�䡢��Ӧ����ȶ�����þ���ʣ������Ա�ʵ��ı�����ͬ���н��
��� �⣺��1�������⣬0.5mol������1.5mol������Ӧ����1mol����ʱ�ų�46.2KJ���������֡�H=��Ӧ��ļ���-������ļ��ܣ�1mol��������3molN-H�����������Ϊx������0.5��948.9+1.5��436.0-3x=-46.2��
�ɽ��x=391.6������N-H���ļ���Ϊ391.6kJ/mol��
�ʴ�Ϊ��391.6 kJ•mol-1��
��2��������������Ӧ����1molˮ��������241.8kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-241.8kJ/mol��������NO��O2��Ӧ����1molNO2���ʱ�Ϊ-57.07KJ���Ȼ�ѧ����ʽΪ��NO��g��+$\frac{1}{2}$O2��g��=NO2��g����H=-57.07KJ/mol �٣�1molNO2��H2O��Ӧ����HNO3��Һ��NO���ʱ�Ϊ-46KJ��NO2��g��+$\frac{1}{3}$H2O��l��=$\frac{2}{3}$HNO3��aq��+$\frac{1}{3}$NO��g������H=-46KJ/mol �ڣ����ݸ�˹���ɣ���+�ڣ���6�õ��Ȼ�ѧ����ʽ��4NO��g��+3O2��g��+2H2O��g��=4HNO3��aq����H=-618.42KJ/mol��
�ʴ�Ϊ��H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-241.8kJ/mol��4NO��g��+3O2��g��+2H2O��g��=4HNO3��aq����H=-618.42KJ/mol��
��3����ˮ�� C��OH-��=C��H+��=2��10-7 mol/L Kw=C��H+��•C��OH-��=2��10-7��2��10-7=4��10-14��ˮ�����ԣ�PH��7�����¶Ȳ��䣬����ϡ����ʹc��H+��=5��10-6mol/L��C��OH-��=$\frac{Kw}{c��{H}^{+}��}$=$\frac{4��1{0}^{-14}}{5��1{0}^{-6}}$=8��10-9 mol/L��
�ʴ�Ϊ��2��10-7����7��8��10-9��
��4��ʵ����ݿ��Ʊ��������жԱ����飬�о��¶ȡ���Ӧʱ�䡢��Ӧ����ȶ�����þ���ʵ�Ӱ�죮
ʵ��ٺۣ͢��¶���ͬ����Ӧʱ����ͬ��Ӧ�о���Ӧ����ȶ�����þ���ʵ�Ӱ�죬���з�Ӧ�����ӦΪ4��1��
ʵ��ں͢ܣ���Ӧʱ����ͬ����Ӧ�������ͬ���¶Ȳ�ͬ��Ӧ��̽���¶ȶԲ��ʵ�Ӱ�죻
���з�Ӧ�����ӦΪ4��1��ʵ��ںۣ͢��¶���ͬ����Ӧ�������ͬ����Ӧʱ�䲻ͬ��̽����Ӧʱ��Բ��ʵ�Ӱ�죮
�ʴ�Ϊ��4��1���¶ȶԲ��ʵ�Ӱ�죻�ۣ�
���� ���⿼����ݼ��������㻯ѧ��Ӧ�ʱ�ķ������Ȼ�ѧ����ʽ��д��ˮ�ĵ���ƽ�⡢��ʵ������ͼ��ķ����Լ���ȡ��Ϣ�����ȣ��Ѷ��еȣ���Ҫѧ���߱���ʵ�Ļ������ۺ�����֪ʶ�������⡢�������������


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
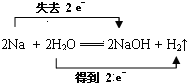 ��Ӧ�У�H2O����������
��Ӧ�У�H2O�����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
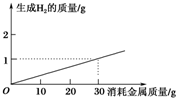
| A�� | ��п | B�� | ���� | C�� | þ���Ͻ� | D�� | ͭ���Ͻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��10 | B�� | 1��5 | C�� | 1��20 | D�� | 1��10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
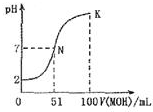 �����£���100mL0.01mol•L-1 HA��Һ����μ���0.02mol-1 MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯�������仯���Բ��ƣ�������˵���в���ȷ����
�����£���100mL0.01mol•L-1 HA��Һ����μ���0.02mol-1 MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯�������仯���Բ��ƣ�������˵���в���ȷ����| A�� | MOHΪһԪ���� | |
| B�� | MA ϡ��ҺPH��7 | |
| C�� | N��ˮ�ĵ���̶ȴ���K��ˮ�ĵ���̶� | |
| D�� | K���Ӧ����Һ��PH=10����C��MOH��+C��OH��-C��H+=0.01mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ὦ�����У�Ӧ�����ü�Һ��ϴ����ϴ��գ�۾� | |
| B�� | ��ʽ�ζ��ܣ���ʽ�ζ��ܡ���Һ�ܶ���ȷ��ȡһ�����Һ���������������ʹ��ʱ��Ҫ���м���Ƿ�©ˮ��ˮϴ����ϴ��עҺ������Һ��ȼ������� | |
| C�� | ��ȥӲ֬������Һ�еĸ��ͷ����ǣ�����Һ�м���ʳ�Σ����� | |
| D�� | �����£�ȷ��ȡ14.8g Ca��OH��2������100mL 2.0 mol/L��Ca��OH��2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
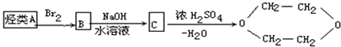
| A�� | ��ϩ | B�� | �Ҵ� | C�� | �Ҷ��� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
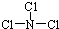 ��X ��ˮ��Ӧ�Ļ�ѧ����ʽ��NCl3+3H2O�TNH3+3HClO��
��X ��ˮ��Ӧ�Ļ�ѧ����ʽ��NCl3+3H2O�TNH3+3HClO���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com