
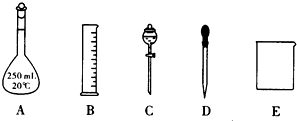
| n |
| V |
| 1000ρω |
| M |
| 1000×1.19g/mL×37% |
| 36.5g/mol |


科目:高中化学 来源: 题型:
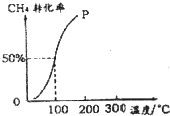 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数 |
| HF | Ka=3.5×10-4 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 | |
| HClO | Ka=3.2×10-8 |
| A、同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 |
| B、结合H+ 的能力:ClO->CO32->F- |
| C、碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF=2F-+H2O+CO2↑ |
| D、次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O=HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
235 92 |
235 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
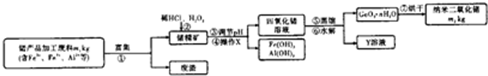
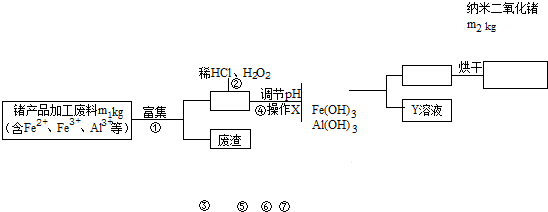
查看答案和解析>>
科目:高中化学 来源: 题型:
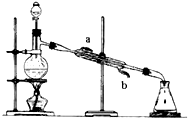 如图所示的仪器装置,在实验室合成乙酸乙酯的粗产品.在蒸馏烧瓶内将过量的乙醇与适量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏.得到含有乙醇、醋酸和水的乙酸乙酯粗产品.
如图所示的仪器装置,在实验室合成乙酸乙酯的粗产品.在蒸馏烧瓶内将过量的乙醇与适量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏.得到含有乙醇、醋酸和水的乙酸乙酯粗产品.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | |
| C | ↓ | ↓ | - | ↑ | - |
| B | ↓ | - | ↓ | - | - |
| A、HCl |
| B、Ca(HCO3)2 |
| C、Na2CO3 |
| D、Ba(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com