
| A、H2O、H2S、H2Se、H2Te |
| B、C(CH3)4、CH(CH3)2CH2CH3、CH3(CH2)3CH3 |
| C、SiO2、NaCl、CCl4、SO2 |
| D、F2、Cl2、Br2、I2 |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
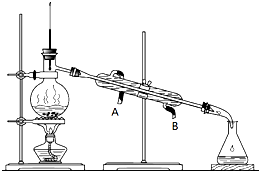 某工厂废液经测定得知主要含有乙醇,其中还有丙酮、乙酸和乙酸乙酯.根据下列各物质的性质
某工厂废液经测定得知主要含有乙醇,其中还有丙酮、乙酸和乙酸乙酯.根据下列各物质的性质| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78.5 | 117.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,前者产生二氧化碳少 |
| B、用洁净铁丝蘸取两种样品在煤气火焰上灼烧,火焰颜色呈黄色的是小苏打 |
| C、分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打 |
| D、先将两样品配成溶液,后分别加入石灰水,无白色沉淀生成的是小苏打 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com