
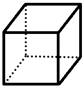
 “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.分析 (1)根据碳原子的价键理论和键线式的特点来书写化学式;
(2)烃的一氯代物的同分异构体等于氢原子的种类;烃的二氯代物的同分异构体可以采用固定一个氯原子的方法来寻找;
(3)氢原子被氯原子取代时,氢原子与Cl2的物质的量之比为1:1.
解答 解:(1)该烃的每一个碳原子均和三个碳原子成键,剩余的一个键是和氢原子成键,所以该烃的分子式为C8H8,故答案为:C8H8;
(2)立方烷中只有一种氢原子,所以一氯代物的同分异构体有1种,二氯代物的同分异构体分别是:一条棱、面对角线、体对角线上的两个氢原子被氯原子代替,所以二氯代物的同分异构体有三种,故答案为:1;3;
(3)氢原子被氯原子取代时,氢原子与Cl2的物质的量之比为1:1,1mol立方烷中有8mol氢原子,需要8mol氯气,故答案为:8.
点评 本题考查有机物的结构与性质、同分异构体的概念和应用知识,要求学生具有整合知识的能力,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
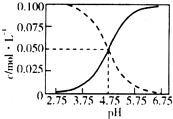 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )| A. | 25℃时,CH3COOH的电离常数K的值5×10-2.75 | |
| B. | 随pH增大,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| C. | pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
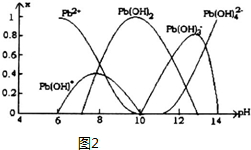
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
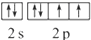 ,该元素的符号是O;
,该元素的符号是O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
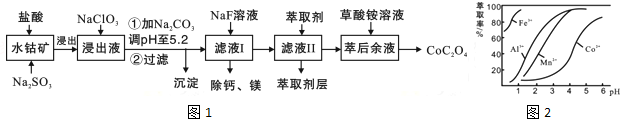
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑦⑧ | B. | ②③④⑥⑦ | C. | ③④⑥⑦⑧ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、CH3CH2CH2CHO.
、CH3CH2CH2CHO.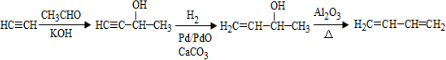 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com