
| A. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸的导电性比强酸溶液的导电性弱 |
分析 A.氢离子浓度小于甲酸浓度,说明甲酸部分电离;
B.水溶性与电解质强弱没有必然关系;
C.甲酸为一元酸,恰好反应时与氢氧化钠的物质的量相等,与电解质强弱无关;
D.导电性强弱与电解质强弱没有必然关系.
解答 解:A.1mol/L甲酸溶液中c(H+)约为1×10-2mol/L,说明甲酸只能部分电离出氢离子,一定为弱电解质,故A正确;
B.不能根据甲酸的溶解性判断电解质强弱,故B错误;
C.10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应,只能说明甲酸为一元酸,不能判断甲酸为弱电解质,故C错误;
D.不能根据溶液导电性判断电解质强弱,故D错误;
故选A.
点评 本题考查了强弱电解质的判断,题目难度不大,明确强弱电解质的概念为解答关键,注意掌握弱电解质的电离特点,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
 为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).
为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
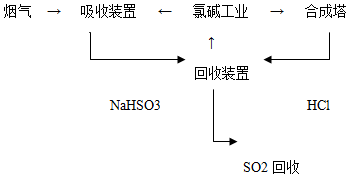
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2?Fe(SO2)63+(反应b) | I、制备Fe(OH)3胶体并检验 II、分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用农作物秸秆制取乙醇 | |
| B. | 回收地沟油,制备生物柴油 | |
| C. | 焚烧废旧塑料,防止白色污染 | |
| D. | 开发利用各种新能源,减少对化石燃料的依赖 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| B. | 近期出现在北方的雾霾是一种分散系,带活性碳口罩的原理是吸附作用 | |
| C. | 亚硝酸钠易致癌,但火腿肠中允许含少量的亚硝酸钠以保持肉质新鲜 | |
| D. | 我国部分城市在推广使用的“甲醇汽油”有降低排放废气的优点,无任何负面作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| B. | 石油是混合物,其分馏产品汽油为纯净物 | |
| C. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 | |
| D. | 石油分馏可获得乙酸、苯及其衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HDO与H2O化学性质不同 | |
| B. | 用漂粉精和洁厕灵(主要成分是盐酸)混合后的浓溶液清洗马桶效果更佳 | |
| C. | 工业上最理想的化学反应是原子利用率达到100%的反应 | |
| D. | 新原子的发现意味着新元素的合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
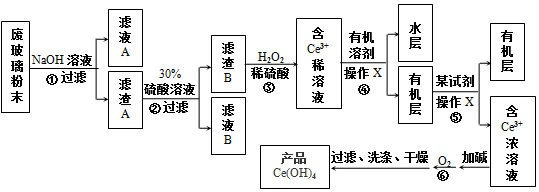
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com