
aF是一种重要的氟盐,主要用作农作物杀虫剂、木材防腐剂等。某课题组设计了以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵的实验,其工艺流程如下:
已知:20 ℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
(1)操作Ⅱ是洗涤、干燥,其目的是 ,
操作Ⅲ和操作Ⅳ的名称依次是 (填写序号)。
a.过滤 b.加热蒸发 c.冷却结晶 d.洗涤
(2)上述流程中①的化学反应方程式:
H2SiF6+ NH4HCO3 NH4F+ H2SiO3↓+ CO2↑+
NH4F+ H2SiO3↓+ CO2↑+
(3)流程①中NH4HCO3必须过量,其原因是 。
(4)若不考虑氟化钠的溶解,7.2 g氟硅酸理论上最多能生产 g氟化钠。
科目:高中化学 来源: 题型:实验题
(15分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
| A.除去SO2气体 | B.除去空气中的水蒸气 | C.有利于气体混合 |
| D.有利于观察空气流速 E.除去反应后多余的氧气 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
对叔丁基苯酚 可用于生产油溶性酚醛树脂等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
可用于生产油溶性酚醛树脂等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚的实验步骤如下:
步骤1:按图16组装仪器,在X中加入2.2 mL叔丁基氯(过量)和1.41 g苯酚,搅拌使苯酚完全溶解。
步骤2:向X中加入无水AlCl3固体作催化剂,不断搅拌,有气体放出。
步骤3:反应缓和后,向X中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器X的名称为 。
(2)步骤2中发生主要反应的化学方程式为 。若该反应过于激烈,可采取的一种措施为 。
(3)图16中倒扣漏斗的作用是 。
(4)实验结束后,对产品进行光谱鉴定结果如下。其中属于红外光谱的谱图是 (填字母)。
(5)本实验中,对叔丁基苯酚的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
)单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。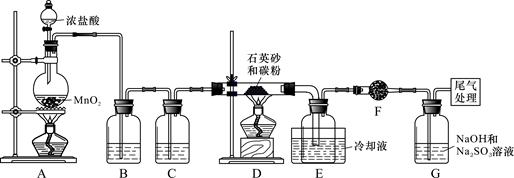
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
| 序号 | 操 作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴 溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴 溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向c试管中滴加几滴 溶液 | | 假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示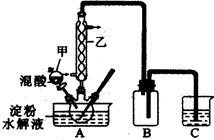
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2︰1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)上图实验装置中仪器乙的名称为:________________________。装置B的作用是 。
(2)检验淀粉是否水解完全的方法:______________________________________________。实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:____________________________________________________。
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;
由此你认为溶液褪色总是先慢后快的原因是_________________________________________。
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4·7H2O 固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解。向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置。倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干。
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是 。
②用丙酮洗涤固体两次的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
乙酰水杨酸俗称阿司匹林(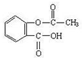 ),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:


制备基本操作流程如下:
主要试剂和产品的物理常数如下表:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |


 ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (百分数精确到0.1)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (百分数精确到0.1)。查看答案和解析>>
科目:高中化学 来源: 题型:实验题
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH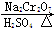 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学学习小组在实验室中探究铁钉与热浓硫酸的反应。其探究流程如图所示: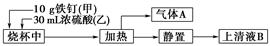
(1)从实验安全的角度考虑,应先向烧杯中加入______(填“甲”或“乙”)。
(2)根据加入的反应物的量,实验需要选取的烧杯的规格为________(填字母序号)。
a.50 mL b.100 mL c.500 mL d.1 000 mL
(3)上述流程图中从“静置”后的混合物中得到上清液B不能采用过滤的操作方法,其原因是__________________________________。
由于铁钉生锈,上清液B中可能既含Fe3+,又含Fe2+,要检验上清液B中有无Fe2+,应加入的试剂是________(填字母序号)。
a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.NaOH溶液
d.酸性KMnO4溶液
(4)气体A的主要成分是SO2,还可能含有H2和CO2。流程图中“加热”时可能生成CO2的原因是________________(用化学方程式表示)。
利用下列仪器可以同时检验气体A中是否含有H2和CO2(其中的夹持仪器、橡胶管和加热装置已经略去),则仪器的连接顺序是________(填仪器的字母代号),装置A的作用是____________________________,装置B中试剂X的化学式是________。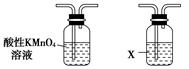
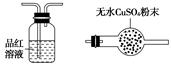
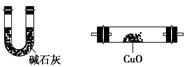
A B C D E F
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下: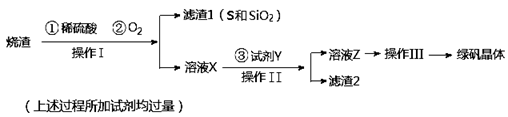
试回答:
(1)操作I为 (填写操作名称)。
(2)试剂Y与溶液X反应的离子方程式为 。
(3)操作III的顺序依次为: 、冷却结晶、过滤、 、干燥。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需 。②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)。
③滴定时发生反应的离子方程式为: 。
④判断此滴定实验达到终点的方法是 ;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为 。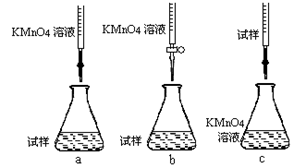
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com