
| A. | 钠与W可以形成Na2W2化合物 | |
| B. | Z与少量的氢氧化钠溶液反应生成两性氢氧化物 | |
| C. | X与氢元素只能形成含共价键的化合物 | |
| D. | WO2与XO2均为酸性氧化物 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,常温下Z的单质能溶于X的最高价氧化物对应的水化物的稀溶液中,不溶于其浓溶液中,说明Z的单质在该浓溶液中发生钝化现象,Z为短周期元素,则Z为Al元素;X的原子序数小于Al,则X为N元素;X的氢化物极易溶于Y的氢化物中,X的氢化物为氨气,氨气极易溶于水,则Y为O元素;W元素的最高正价与最低负价代数和为+4,W位于ⅥA族,其原子序数大于Al,应该为S元素,据此进行解答.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,常温下Z的单质能溶于X的最高价氧化物对应的水化物的稀溶液中,不溶于其浓溶液中,说明Z的单质在该浓溶液中发生钝化现象,Z为短周期元素,则Z为Al元素;X的原子序数小于Al,则X为N元素;X的氢化物极易溶于Y的氢化物中,X的氢化物为氨气,氨气极易溶于水,则Y为O元素;W元素的最高正价与最低负价代数和为+4,W位于ⅥA族,其原子序数大于Al,应该为S元素,
A.W为O元素,钠与O可以形成Na2O2,故A正确;
B.Z为Al元素,Al与氢氧化钠溶液反应生成偏铝酸钠和水,没有两性氢氧化物生成,故B错误;
C.X为N元素,N与H元素可以形成离子化合物,如NH4N3,故C错误;
D.WO2与XO2分别为SO2与NO2,二氧化硫为酸性氧化物,而NO2不属于酸性氧化物,故D错误;
故选A.
点评 本题考查位置结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题有利于提高学生的分析能力及逻辑推理能力.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液的浓度增大 | |
| B. | 溶液的pH增大 | |
| C. | 溶液中钠离子与碳酸根离子的物质的量之比变小 | |
| D. | 溶液的质量分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通氢气的一极是正极,通氧气的一极是负极 | |
| B. | 通氢气的一极发生的是还原反应 | |
| C. | 工作一段时间后电解质溶液的pH值减小 | |
| D. | 工作时负极区附近的pH值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
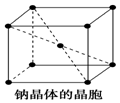 金属钠晶体为体心立方晶格(如图),实验测得钠的密度为ρ(g•cm-3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(molC-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )
金属钠晶体为体心立方晶格(如图),实验测得钠的密度为ρ(g•cm-3).已知钠的相对原子质量为a,阿伏加德罗常数为NA(molC-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切.则钠原子的半径r(cm)为( )| A. | $\root{3}{\frac{2a}{{N}_{A}ρ}}$ | B. | $\sqrt{2}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$ | C. | $\frac{\sqrt{3}}{4}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$ | D. | $\frac{1}{2}$$\root{3}{\frac{2a}{{N}_{A}ρ}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池中一定是相对较活泼的金属做负极不活泼的金属做正极 | |
| B. | 在原电池中,电子流出的一极是负极,该电极被还原 | |
| C. | 原电池可以把物质内部的能量全部转化为电能 | |
| D. | 实验室欲快速制取氢气,可利用粗锌与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 动物体内的葡萄糖被氧化为CO2的过程是热能转化为化学能的过程 | |
| B. | 植物的光合作用是把太阳能转化为热能的过程 | |
| C. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 | |
| D. | 电解饱和食盐水是把化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄砷中共价键键能大于白磷 | B. | 黄砷的熔点高于白磷 | ||
| C. | 黄砷易溶于水 | D. | 分子中共价键键角均为109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物:铝热剂、液氨、铝合金、酒精 | |
| B. | 化合物:干冰、冰水混合物、烧碱、小苏打 | |
| C. | 电解质:氯化钠、硫酸钡、氯化氢、水 | |
| D. | 同素异形体:活性炭、C60、石墨烯、金刚石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com