
 某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.
某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.| 1 |
| 2 |


科目:高中化学 来源: 题型:
A、氢氧化钡溶液与等物质的量的稀H2SO4混合:Ba2++OH-+H++SO
| ||||
| B、氨气通入醋酸溶液中:CH3COOH+NH3═CH3COONH4 | ||||
C、碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO
| ||||
| D、澄清石灰水与盐酸反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O |
| C、碳酸钡溶于稀硝酸:BaCO3+2H+=Ba2++CO2↑+H2O |
| D、钠与水的反应:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键 |
| B、X单质可以通过铝热法获得 |
| C、Y的氧化物是良好的半导体材料 |
| D、Z的氢化物比W的氢化物更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 重要现象或事实 | 所得结论 |
| 能用小刀切割金属钠 | ① |
| ② |
金属钠的熔点低 |
| ③ |
属钠与水反应有碱生成 |
| ④ |
金属钠与水反有气体生成 |
| 金属钠加入水中,浮在水面上 | ⑤ |
| 小刀切开金属的面,金属光泽迅速变暗 | ⑥ |
| 过氧化钠加入水中,所得气体使带火星的木条复燃 | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
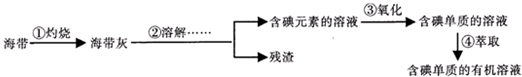
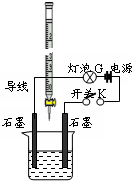
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3- SO42- I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物的稳定性按X、Y、Z的顺序递减 |
| B、三种元素的含氧酸酸性H4ZO4>H3YO4>H2XO4 |
| C、元素的最高正价按X、Y、Z的顺序递减 |
| D、元素原子的半径按X、Y、Z的顺序递减 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com