
| A. | 在复盐NH4Fe(SO4)2溶液中加入过量的Ba(OH)2溶液:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| B. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| C. | 在燃煤时加入适量石灰石粉末,可减少SO2的排放:CaCO3+SO2═CaSO3+CO2 | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
分析 A.氢氧化钡过量,反应生成硫酸钡、一水合氨、氢氧化铁沉淀;
B.碳酸钙溶解度小于硫酸钙,依据沉淀转化规律解答;
C.在燃煤时加入适量石灰石粉末,反应生成硫酸钙、二氧化碳;
D.过氧化氢氧化碘离子生成单质碘.
解答 解:A.在复盐NH4Fe(SO4)2溶液中加入过量的Ba(OH)2溶液,离子方程式:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O,故A正确;
B.在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4可降低土壤的碱性,化学方程式:CaSO4+Na2CO3═CaCO3+Na2SO4,故B正确;
C.在燃煤时加入适量石灰石粉末,可减少SO2的排放,化学方程式:O2+2CaCO3+2SO2═2CaSO4+2CO2,故C错误;
D.用过氧化氢从酸化的海带灰浸出液中提取碘,离子方程式:2H++2I-+H2O2═I2+2H2O,故D正确;
故选:C.
点评 本题考查了化学方程式、离子方程式的书写,明确反应实质 是解题关键,注意反应物用量对反应的影响,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中加入铁粉:Fe+Fe3+═2Fe2+ | |
| B. | NH4HSO4溶液中加入少量NaOH:NH4++OH-═NH3•H2O | |
| C. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 氯气通入Na2SO3溶液中:Cl2+SO32-+H2O═SO42-+2H++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液加入几滴KSCN溶液后不变色再滴加几滴氯水后,溶液变红,说明该溶液一定有Fe2+ | |
| B. | 某溶液滴加AgNO3溶液产生白色沉淀,说明该溶液一定含Cl- | |
| C. | 某溶液加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,说明该溶液一定有CO32- | |
| D. | 某溶液滴加盐酸酸化的BaCl2溶液后,有白色沉淀产生,说明该溶液一定含SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
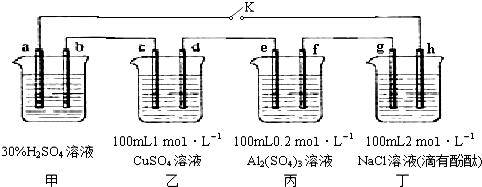
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )
甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断不正确的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 丁的氧化物可用于制造光导纤维 | |
| D. | 常温下,甲和乙的单质均能与水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
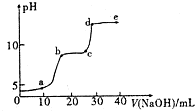 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
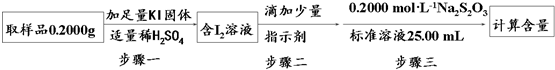
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com