
【题目】将一定量的钠铝合金置于水中,合金全部溶解,得到 20mL pH=14的溶液,然后用1 mol·L-1的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示:

写出有关反应的化学方程式:
(1)______________________________ ;(2)______________________________;
(3)______________________________ ;(4)____________________________ ;
(5)____________________________。
【答案】 略 略 略 略 略
【解析】(1)钠溶于水,与水反应生成氢氧化钠和氢气,方程式为2Na + 2H2O=2NaOH + H2↑;(2)生成的氢氧化钠能与铝反应生成偏铝酸钠和氢气,方程式为 2Al + 2NaOH + 2H2O=2NaAlO2 + 3H2↑ ;(3)根据图像可知滴加盐酸时没有沉淀,说明氢氧化钠过量,发生中和反应:NaOH + HCl=HCl + H2O;(4)氢氧化钠被中和后盐酸与偏铝酸钠反应生成氢氧化铝沉淀,方程式为NaAlO2 + HCl+ H2O=Al(OH)3 ↓+ NaCl;(5)由于氢氧化铝是两性氢氧化物,盐酸过量后发生反应Al(OH)3 + 3HCl=AlCl3 + 3H2O。


科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为______mol/(L·min)。
(2)在实验2,A的初始浓度C2=______mol/L。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3_____V1(填>、=、<),且C3_____1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。理由是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将一定量碳酸氢铵固体置于容积不变密闭容器中,发生反应:
NH4HCO3(s)![]() NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
A. 若容器内混合气体的密度不变,则说明反应达到平街状态
B. 若CO2体积分数不再发生变化,则说明反应达到平街状态
C. 若升高体系温度,则正、逆反应速率均增大
D. 若反应过程中吸收QkJ热量,则刚好有lmol NH4HCO3发生分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 23g Na 与足量H2O反应完全后可生成NA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4LN2和H2混合气中含NA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学探究性学习小组拟用锌粒与足量稀盐酸反应测定通常状况(约20 ℃,1 atm)下H2的气体摩尔体积。设计实验装置和实验步骤如下:
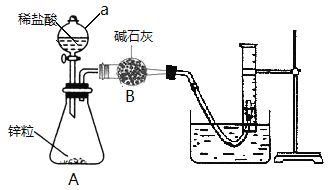
①连接如图所示装置,并检查装置的气密性
②向a仪器中装入VmL稀盐酸,锥形瓶中加入锌粒,B中加入碱石灰;
③称取A装置和B仪器和药品的总质量,记为m g;
④采取措施使装置A中发生反应;
⑤反应停止后,测得在通常状况下收集的气体体积为b mL;
⑥再次称量A装置和B仪器得总质量(含内装物质),记为n g;
⑦处理数据等。
(1)仪器a的名称为_____________。
(2)写出锥形瓶中发生反应的离子方程式____________________________________________________________。
(3)写出检查装置A气密性的方法______________________________________________________________________。
(4)根据上述数据,计算在通常状况下,H2的摩尔体积Vm=__________________________L·mol-1(用含m、b、n等字母的代数式表示)。
(5)若拆除B仪器(其他仪器不变),_______________________________(填“会”或“不会”)对本实验产生影响,理由是______________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色混合物水溶液,可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Ba2+、Cl-、CO32-、SO42-。取100mL该溶液进行如下实验(气体体积在标准状况下测定):
I.向该溶液中加入足量稀盐酸,在标准状况下放出0.56 L气体(不考虑气体溶解);
II.向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g;
试回答下列问题:
(1)肯定存在的离子有______________________________,肯定不存在的离子有___________________________________;
(2)可能存在的离子是__________________________________________________,判断该离子存在与否的方法是______________________________________________________________________________________________________________________________________;
(3)肯定存在的阳离子在原溶液中的物质的量浓度至少为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AJ 10种物质的转化关系如图所示:
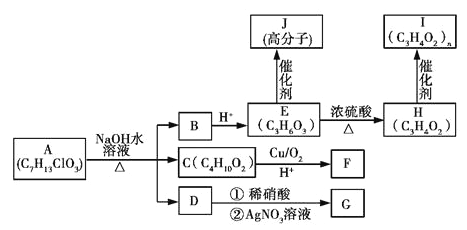
已知:①E分子中含有一个连有4个不同原子或原子团的碳原子。
②C分子中核磁共振氢谱中显示有四种不同的氢原子,且峰面积之比为4∶3∶2∶1。
③1 mol F与足量的新制氢氧化铜在加热条件下充分反应可生成2 mol砖红色沉淀。
④G为白色沉淀。
请回答下列问题:
(1)A中含有的含氧官能团的名称是______________。
(2)B的结构简式为__________________________。
(3)E生成H的化学方程式为_______________________________________。
(4)D的化学名称是__________________________________。
(5)高分子化合物J的结构简式为_______________________________。
(6)与C具有相同的官能团和相同的官能团数目,且官能团不在同一个碳原子上的C的同分异构体共有__________种,其中核磁共振氢谱有三种不同化学环境的氢原子,且峰面积之比为2∶2∶1的是________________________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列制备单质的方法中,需要加入还原剂才能实现的是( )
A. 高炉炼铁 B. 电解法制金属镁
C. 加热氧化汞制金属汞 D. 从海带灰浸取液中(含I-)提取碘单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com