
 pC的可逆反应达到平衡:
pC的可逆反应达到平衡:科目:高中化学 来源:不详 题型:计算题
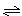 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
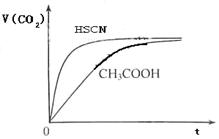
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入催化剂后H2 和O2反应生成水 |
| B.棕红色NO2加压后颜色先变深后变浅 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
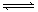 cC(g)+dD(g)达平衡后,保持温度不变,将容器体积压缩到原来的一半。当达到新的平衡时,D的浓度为原平衡时的1.6倍,则
cC(g)+dD(g)达平衡后,保持温度不变,将容器体积压缩到原来的一半。当达到新的平衡时,D的浓度为原平衡时的1.6倍,则| A.平衡向正反应方向移动 | B. A的转化率变小 |
| C.D体积分数变大 | D.a>c+d |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
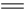 C(g) +D(g) △H-T△S="(-4500+11T)" J/mol,要防止反应发生,温度必须:
C(g) +D(g) △H-T△S="(-4500+11T)" J/mol,要防止反应发生,温度必须:| A.高于409K | B.低于136 K |
| C.高于136K而低于409K | D.低于409K |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
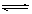 B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(
B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(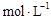 )随反应时间(min)的变化情况如下表:
)随反应时间(min)的变化情况如下表:| 实验 序号 | | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
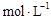 ,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。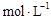 。
。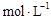 ;该反应的平衡常数K (填“不变”或“增大”或“减小”)。
;该反应的平衡常数K (填“不变”或“增大”或“减小”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
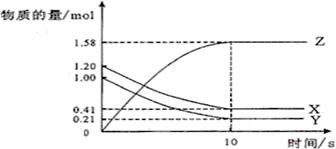
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) | B.反应开始时10s,X的物质的量浓度减少了0.79mol/L | C.反应开始时10s,Y的转化率为79.0% | D.反应的化学方程式为:X(g)+Y(g)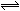 Z(g) Z(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
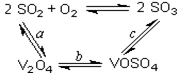
 SO3+ V2O4
SO3+ V2O4  2V2O5+4SO3。
2V2O5+4SO3。| 压强/MPa 温度/℃ | 0.1[ | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |

 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com