

| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有两种同分异构体 | |
| C. | 它的分子式为C8H8 | |
| D. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
分析 立方烷分子式为C8H8,为立方体形,且分子结构是对称的,只有1种氢原子,结合分子的空间结构解答该题.
解答 解:A.立方烷整个分子的结构是立方体形,且分子结构是对称的,只有1种氢原子,立方烷的一氯代物只有一种,故A正确;
B.立方烷二氯代物有3种:两个氯原子在立方体同边有一种情况,两个氯原子的位置在对角有两种情况,所以同分异构体有三种,故B错误;
C.由结构简式可知立方烷分子式为C8H8,故C正确;
D.苯乙烯的分子式与立方烷的分子式相同,但结构不同,所以它们互为同分异构体,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,题目主要考查球棍模型、同分异构体的判断等,注意等效氢的判断,题目难度中等.


科目:高中化学 来源: 题型:实验题
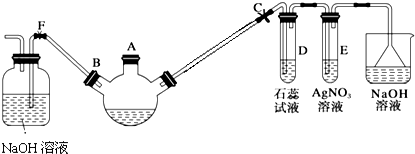
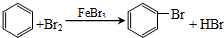 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.0% | B. | 14.3% | C. | 19.0% | D. | 66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C分别充入等质量的X、H2、Y三种气体.当隔板静止时,A、C内的气体密度相等,下列说法不正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C分别充入等质量的X、H2、Y三种气体.当隔板静止时,A、C内的气体密度相等,下列说法不正确的是( )| A. | 摩尔质量:M(X)=M(Y) | B. | 分子的数目:N (X)=N(Y) | ||
| C. | 气体的体积:V(X)=V(Y) | D. | 物质的质量:m(X)<n(H2)<n(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g S在反应中转移电子数为0.2NA | |
| B. | 0.1mol Fe在反应中转移电子数为0.3NA | |
| C. | 6.5g Zn在反应中转移电子数为0.2NA | |
| D. | 11.2L O2在反应中转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取5.1gNa2CO3,加入500mL水 | |
| B. | 称取13.7gNa2CO3•10H2O,配成500mL溶液 | |
| C. | 称取5.3Na2CO3,加入500mL水 | |
| D. | 称取14.3gNa2CO3•10H2O,配成500mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
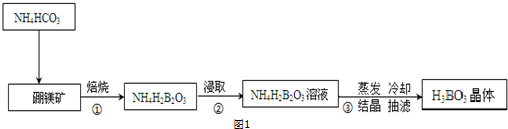
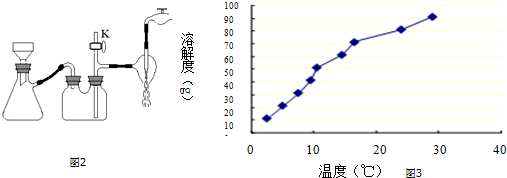
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com