
X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是()
A. Y的阴离子Y﹣的还原性强于X的阴离子X﹣
B. X的氢化物的水溶液的酸性比Y的氢化物的水溶液的酸性强
C. X的单质X2能将Y的阴离子Y﹣氧化成Y2
D. X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价
考点: 非金属在元素周期表中的位置及其性质递变的规律.
专题: 元素周期律与元素周期表专题.
分析: 比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、阴离子的还原性、氢化物的稳定性等角度判断.
解答: 解:A.元素的非金属性越强,对应的阴离子的还原性越弱,Y的阴离子Y﹣的还原性强于X的阴离子X﹣,则非金属性:X>Y,故A正确;
B.不能根据氢化物的酸性来判断非金属性强弱,例如HI的酸性比HCl强,但非金属性Cl>I,硫化氢的酸性比盐酸弱,但非金属性Cl>S,故B错误;
C.元素的非金属性越强,对应的单质的氧化性越强,X的单质X2能将Y的阴离子Y﹣氧化,并发生置换反应,可说明非金属性:X>Y,故C正确;
D.X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价,说明X得电子能力强,非金属性强,故D正确.
故选B.
点评: 本题考查非金属性的判断,题目难度不大,注意非金属性的递变规律以及比较非金属性的角度.


科目:高中化学 来源: 题型:
在Na+浓度为0.5mol•L﹣1的某澄清溶液中,还可能含有下表中的若干种离子.
阳离子 K+Ag+Mg2+Ba2+
阴离子 NO3﹣、CO32﹣、SiO32﹣、SO42﹣
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号 实验内容 实验结果
Ⅰ 向该溶液中加入足量稀盐酸 产生白色沉淀并放出标准状况下0.56L气体
Ⅱ 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 固体质量为2.4g
Ⅲ 向Ⅱ的滤液中滴加BaCl2溶液 无明显现象
请回答下列问题.
(1)实验Ⅱ,混合液过滤后如何洗涤沉淀? .
(2)澄清溶液中一定不存在的离子是 .
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写表中阴离子的物质的量浓度(能计算出结果的填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
阴离子 NO3﹣ CO32﹣ SiO32﹣ SO42﹣
c/mol•L﹣1 ?
(4)判断K+是否存在,若存在,求其最小浓度,若不存在,请说明理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数,下列说法正确的是()
A. 1mol Na2O2与水反应时,转移电子的数目为2NA
B. 标准状况下,22.4L水中含有水分子的数目为NA
C. 14g N2中含有电子的数目为7NA
D. 数目为NA的一氧化碳分子和0.5mol甲烷的质量比为7:4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色.
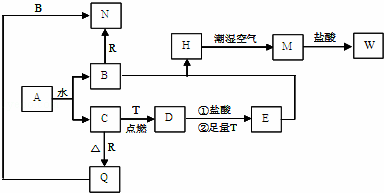
(1)写出下列物质的化学式:D: E: N: .
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(3)按要求写方程式:
B和R反应生成N的离子方程式: ;
M→W的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)﹣空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%﹣30%的KOH溶液.电池总反应为:N2H4+O2=N2↑+2H2O.下列关于该燃料电池工作时的说法正确的是()
A. 电池工作时,负极附近溶液的碱性增强
B. 正极的电极反应式是:O2+4H++4e﹣=2H2O
C. 负极的电极反应式是:N2H4+4OH﹣﹣4e﹣=4H2O+N2↑
D. 溶液中阴离子向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
120℃,某气态烃在密闭容器中与足量的O2混合点燃,完全燃烧后恢复至原温度,容器内的压强保持不变,则该烃是()
A. CH4 B. C2H6 C. C3H6 D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应A2+B2═2AB的能量变化如图所示,则下列说法正确的是()
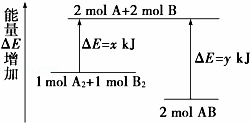
A. 该反应是吸热反应
B. 断裂1 mol A﹣A键和1 mol B﹣B键能放出x kJ能量
C. 形成2 mol A﹣B键需要放出y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是(NA表示阿伏加德罗常数)()
A. 常温常压下,22.0 gCO2所含的电子数为22NA
B. 常温常压下,1mol氦气含有原子数为NA
C. 0.5mol•L﹣1 Na2CO3溶液中含有Na+离子的数目为NA
D. 标准状况下,22.4LCCl4含有的氯原子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在HF、H2S、NH3、BF3、CCl4、N2、SO2分子中:
(1)以非极性键结合的非极性分子是
(2)以极性键相结合,具有平面正三角形结构的非极性分子是
(3)以极性键相结合,具有正四面体结构的非极性分子是
(4)以极性键相结合,具有三角锥型结构的极性分子是
(5)以极性键相结合,具有V型结构的极性分子是
(6)以极性键相结合,而且分子极性最大的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com