
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物,A的单质常温下为密度最小的气体;B与Z的最外层电子数之比为2:3,常见化合物Y2X2是淡黄色固体,能与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Y的原子结构示意图为; Z在周期表中的位置是;B元素的名称为碳.
(2)化合物Y2X2属于A(填序号).
A.离子化合物 B.共价化合物
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为.
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入(填物质名称);放电时KOH溶液中的OH﹣往负极方向移动(填正或负).
(5)1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为了有效发展民用氢能源,首先必须制得廉价的氢气.下列可供开发、较经济又具有广阔前景的制氢方法是(填写编号)
①光解海水 ②锌和稀硫酸反应.
考点: 位置结构性质的相互关系应用.
分析: 常见的10电子化合物有CH4、NH3、H2O、HF等,多为氢化物,A与B和A与X均可形成10个电子化合物,则A为H元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则该化合物为Na2O2,其中Y为Na元素,X为O元素,X与Z同主族,则Z为S元素,最外层电子数为6,B与Z的最外层电子数之比为2:3,则B的最外层电子数为4,根据A、B、X、Y和Z是原子序数依次递增可知B为C元素,根据元素所在周期表中的位置,原子结构以及对应化合物的性质解答该题.
解答: 解:常见的10电子化合物有CH4、NH3、H2O、HF等,多为氢化物,A与B和A与X均可形成10个电子化合物,则A为H元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则该化合物为Na2O2,其中Y为Na元素,X为O元素,X与Z同主族,则Z为S元素,最外层电子数为6,B与Z的最外层电子数之比为2:3,则B的最外层电子数为4,根据A、B、X、Y和Z是原子序数依次递增可知B为C元素,
(1)Y为Na元素,钠离子的核电荷数为11,核外电子总数为10,其离子结构示意图为: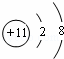 ;Z为S元素,原子核外有3个电子层,最外层电子数为6,位于周期表第三周期ⅥA族;B为C元素,名称为碳,
;Z为S元素,原子核外有3个电子层,最外层电子数为6,位于周期表第三周期ⅥA族;B为C元素,名称为碳,
故答案为: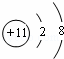 ;第三周期ⅥA族;碳;
;第三周期ⅥA族;碳;
(2)化合物Y2X2为Na2O2,其电子式为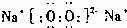 ,属于离子化合物,故A正确,
,属于离子化合物,故A正确,
故答案为:A;
(3)A与X和A与Z形成的18电子化合物分别为H2O2、H2S,其中H2O2具有氧化性,H2S具有还原性,二者发生氧化还原反应生成S和H2O,反应的化学方程式为:H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O;
(4)碱性氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为电源的正极;氢氧根离子带负电荷,其移动方向与电流方向相反,电解质溶液中,电流从负极流向正极,则氢氧根离子向负极移动,
故答案为:氧气;负;
(5)①光解海水,可充分利用光能,廉价而又低碳,符合要求,故①正确;
②锌和稀硫酸反应,消耗大量的锌和硫酸,不符合廉价的要求,故②错误;
故答案为:①.
点评: 本题考查元素位置结构性质的关系及应用,题目难度中等,本题侧重于物质的结构和性质的考查,学习中注重相关基础知识的积累,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
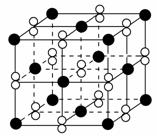 高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是 ( )。
高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是 ( )。
A.KO2中只存在离子键
B.超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C.晶体中与每个K+距离最近的O2-有6个
D.晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下 :




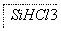

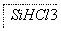


①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、
HCl和另一种物质,写出配平的化学反应方程式____________________;H2
还原SiHCl3过程中若混有O2,可能引起的后果是____________________。
(2)下列有关硅材料的说法正确的是 ( )。
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,
振荡。写出实验现象并给予解释(用化学方程式说
明)____________________________________________________________。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,
这种材料是________(填字母)。
A.高温结构陶瓷 B.生物陶瓷 C.导电陶瓷
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、R、Q是短周期元素,R、Q和X、Y分别处于同一周期,R、Y处于同一主族,Q2﹣和X2+具有相同的电子层结构,其中Q是地壳中含量最高的元素,R最外层电子数是次外层的2倍.下列说法正确的是()
A. 离子半径:Q2﹣>X2+
B. 原子序数:Y>R>Q
C. 简单气态氢化物的稳定性:R>Q>Y
D. 原子最外层电子数:X>Y>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是()
A. CH3Cl不存在同分异构体 B. CH2Cl2不存在同分异构体
C. CHCl3不存在同分异构体 D. CCl4不存在同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,反应X(g)+3Y(g)⇌2Z(g)达到化学平衡状态的标志是( )
|
| A. | X、Y、Z的分子数比为1:3:2 |
|
| B. | 单位时间生成amolX,同时生成3a molY |
|
| C. | X、Y、Z的浓度相等 |
|
| D. | 3v正(X)=v逆(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关沉淀溶解平衡的说法中,正确的是( )
|
| A. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度 |
|
| B. | 在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大 |
|
| C. | 在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动 |
|
| D. | 向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.
已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol﹣1,
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534kJ•mol﹣1.
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式: .
(2)已知:N≡N的键能是946kJ•mol﹣1,H﹣H的键能为436kJ•mol﹣1,N﹣H的键能为393kJ•mol﹣1,计算合成氨反应生成1molNH3的△H= kJ•mol﹣1.
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为
②加水稀释100倍,所得溶液中由水电离出c(OH﹣)=
③与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11,该盐酸溶液的pH= .
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO﹣)(填“>”或“=”或“<”).
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO﹣).
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
A~G是几种烃的分子球棍模型(如图)

据此回答下列问题:
(1)常温下含碳量最高的气态烃是 (填对应字母).
(2)能够发生加成反应的烃有(填数字) 种.
(3)一卤代物种类最多的是(填对应字母) .
(4)写出实验室制取C的化学方程式 .
(5)写出F发生溴代反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com