
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行探究:
Ⅰ. 鉴别NaCl和NaNO2
甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL0.0001mol/L两种盐溶液的试管中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有_____________溶液的试管。
乙同学测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性。该溶液呈碱性的原因是__________(用离子方程式解释)。
Ⅱ. 如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。

(1)装置B中试剂X是_______,装置D中盛放NaOH溶液的作用是_______________________。
(2)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是_____________________________________。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为______________;发生反应的离子方程式是_____________________。
Ⅲ. 用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入右图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:

(1)M极发生的电极反应式为____________________________。
(2)若使该装置的电流强度达到2.0 A,理论上每分钟应向负极通入标准状况下气体的体积为_____L(已知:1个e所带电量为1.6×10-19C)。(保留两位有效数字)
【答案】 NaCl NO2-+H2O![]() HNO2+OH- 浓H2SO4 吸收未反应的SO2 防止污染空气 将带火星的木条放在D试管口处,看木条是否复燃 E中溶液蓝色褪去
HNO2+OH- 浓H2SO4 吸收未反应的SO2 防止污染空气 将带火星的木条放在D试管口处,看木条是否复燃 E中溶液蓝色褪去 ![]()
![]() 0.014
0.014
【解析】Ⅰ.溶度积表达式相同时,溶度积小的先生成沉淀,根据溶度积常数知Ksp(AgNO2)>Ksp(AgCl),所以NaCl先生成沉淀;NaNO2说明为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性,其水解方程式为NO2-+H2OHNO2+OH-;
Ⅱ.实验方案二:装置A中制备二氧化硫,X干燥二氧化硫,C中检验SO2与Na2O2反应是否有氧气,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气.E装置验证二氧化硫的还原性,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气;
(1)装置B中试剂X干燥氯气,盛放试剂是浓硫酸,装置D中盛放NaOH溶液的作用是:吸收未反应的SO2,防止污染空气;
(2)检验SO2与Na2O2反应是否有氧气生成的方法是:将带火星的木条放在D试管口处,看木条是否复燃;
(3)能说明I-还原性弱于SO2的现象为:E中溶液蓝色褪去,发生反应的离子方程式是:SO2+I2+2H2O=2I-+SO42-+4H+;
Ⅲ.实验方案三:(1)本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成,电极反应式为:SO2+2H2O-2e -═SO42-+4H+;
(2)转移电子物质的量为(2A×60s÷1.6×10-19C)÷6.02×1023mol-1,则需要二氧化硫体积为:[(2A×60s÷1.6×10-19C)÷6.02×1023mol-1]÷2×22.4L/mol≈0.014L。


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:
【题目】芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
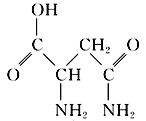
(1)天冬酰胺所含元素中,________(填元素名称,下同)元素基态原子核外未成对电子数最多,第一电离能最大的是________。
(2)天冬酰胺中碳原子的杂化轨道类型为________,分子中σ键和π键数目之比为________。
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表。
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为________________________________________。
H2O、H2S、H2Se沸点由高到低的顺序为________________,酸性由强到弱的顺序为________________。
(4)写出铬的基态原子电子排布式:________________________________________。
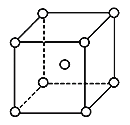
(5)铬为体心立方晶体,晶胞结构如图,则该晶胞中含有______个铬原子。若铬的密度为ρg·cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是一种液体,易分解为水和氧气,常作氧化剂、漂白剂和消毒剂,为贮存、运输、使用的方便,工业常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是
A.MnO2 B.H2S C.稀盐酸 D.NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①—⑩在表中的位置回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)③和⑧的最高价含氧酸的酸性强弱关系是_____________________________(用化学式填写)。
(2)⑥、⑦、⑩的简单离子的离子半径由大到小的顺序是________________(用离子符号表示)。
(3)由⑨与⑩形成的某种分子中各原子都满足最外层为8电子结构,其化学式是_________;由⑤与⑥形成的某种化合物中含有两类化学键,该化合物的电子式为___________。
(4)⑦的最高价氧化物对应水化物与⑥的最高价氧化物对应水化物反应的离子方程式为:________。
(5)⑧与⑩相比,非金属性较强的是_______(用元素符号表示),下列事实能证明这一结论的是_______(填字母序号)
a. 常温下⑧的单质呈固态,⑩的单质呈气态
b. ①与⑧和⑩形成的化合物分别为X和Y,稳定性Y>X
c. ⑧与⑩形成的化合物中⑧呈正价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种一元酸HA、HB、HC的钠盐分别为NaA、NaB、NaC,它们的物质的量浓度相同时,溶液的PH依次为9,10,8.则这三种弱酸的酸性由强到弱的顺序是( )
A. HA>HB>HC B. HB>HA>HC C. HC>HB>HA D. HC>HA>HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中
A. 一定有SO42- B. 可能有SO42- 或Ag+ C. 一定无Ag+ D. 还可能有CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com