
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据概念书写热化学方程式,根据方程式进行计算;
(2)依据题干信息结合元素守恒计算有机物,依据热化学方程式书写方法标注物质聚集状态和反应焓变写出.
解答 解:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据概念书写热化学方程式,标注物质聚集状态和对应焓变,即2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,所以产生571.6kJ的能量需要燃烧2mol氢气,若要得到1000kJ的热量,需完全燃烧氢气的物质的量是$\frac{1000×2}{571.6}$mol=3.5mol,C的燃烧热:△H=-393.5kJ•mol-1,即C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,2.5molC在O2中完全燃烧生成CO2,放出的热量为:393.5kJ×2.5=983.8kJ,
故答案为:3.5; 983.8;
(2)2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g水物质的量=$\frac{2.7g}{18g/mol}$=0.15mol,2.24L CO2(标准状况)物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(C)=0.1mol,n(H)=0.3mol,n(O)=$\frac{2.3g-0.1mol×12g/mol-0.3mol×1g/mol}{16g/mol}$=0.05mol,
则n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6;1,化学式为C2H6O,物质的量为0.05mol,并放出68.35kJ热量,1mol有机物燃烧放热1367KJ,热化学方程式为:C2H6O(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367kJ/mol;
故答案为:C2H6O(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367kJ/mol.
点评 本题考查了化学反应能量变化,燃烧热概念分析应用以及热化学方程式的计算等知识,注意知识的迁移应用是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 7.35 mol/L | B. | 8.70 mol/L | C. | 10.05 mol/L | D. | 11.40 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅是非金属元素,它的单质是灰黑色有金属光泽的固体 | |
| D. | 加热到一定温度时硅能与H2、O2等非金属反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于 57.3 kJ | B. | 等于 57.3 kJ | C. | 小于 57.3 kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子的骨架分类方法一般用于烃的分类 | |
| B. | 五个碳原子的环状化合物肯定是脂环化合物 | |
| C. | 不含苯环的碳环化合物都属于脂环化合物 | |
| D. | 芳香化合物就是指苯及苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
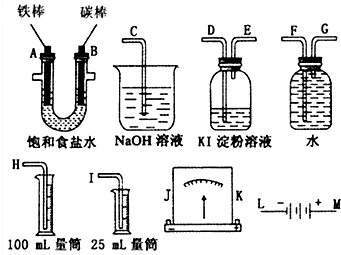 某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.
某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
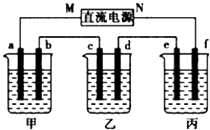 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com