
| A. | 原子半径的大小顺序为 W>Q>Z>X>Y | |
| B. | 元素 Y 与 W 对应氢化物的沸点 H2Y>H2W | |
| C. | 元素 X 与 Y 可以形成 5 种以上的化合物 | |
| D. | 元素 Q 的最高价氧化物对应的水化物酸性比 W 的强 |
分析 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,联想NH3极易溶于水,可知X为氮元素,Y为氧元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为铝元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化;Q只能为氯元素.
解答 解:短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,联想NH3极易溶于水,可知X为氮元素,Y为氧元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为铝元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化;Q只能为氯元素.
A.电子层越多半径越大,电子层相同时核电荷数越多半径越小,故原子半径Al>S>Cl>N>O,即原子半径Z>W>Q>X>Y,故A错误;
B.元素O 与 S 对应氢化物的沸点,水分子间存在氢键,沸点异常的高,所以沸点 H2O>H2S,故B正确;
C.元素 N 与O 可以形成N2O、NO、N2O3、NO2、N2O4、N2O5六种氧化物,故C正确;
D.元素 氯的最高价氧化物对应的水化物高氯酸的酸性比 硫酸的酸性强,故D正确;
故选A.
点评 本题考查元素周期律、结构位置性质关系,推断元素是解题关键,需要学生熟练掌握元素化合物性质,难度中等.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题

| A. | 图①中正极附近溶液pH减小 | |
| B. | 图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液 | |
| C. | 图②正极反应是O2+2H2O+4e-═4OH- | |
| D. | 图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
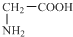

| A. | 全部 | B. | ①②④⑤⑥ | C. | ②③④⑤⑥ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转化为化学能的装置 | |
| B. | 原电池中发生氧化反应的是负极 | |
| C. | 电解池是将化学能转化为电能的装置 | |
| D. | 电解池中发生氧化反应的是阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
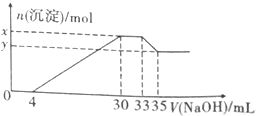 在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在100ml含Cu2+、Al3+、NH4+、H+、NO3-的溶液中,逐滴加入2.5mol•L-1NaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | x-y=2×10-3mol | B. | 原溶液的pH=2 | ||
| C. | 原溶液中n(Cu2+)=0.025mol | D. | 原溶液中c(NH4+)=7.5×10-3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极呈无色,阳极呈红色 | B. | 正极呈红色,负极呈无色 | ||
| C. | 阳极呈无色,阴极呈红色 | D. | 负极呈红色,正极呈无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
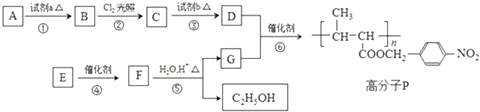
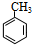 .
.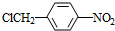 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$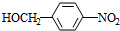 +NaCl.
+NaCl.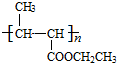 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$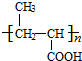 +n CH3CH2OH.
+n CH3CH2OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com