
【题目】在恒温恒容的容器中进行反应 2SO3(g)![]() 2SO2(g)+O2(g),若反应物浓度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反应的时间为
2SO2(g)+O2(g),若反应物浓度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反应的时间为
A. 等于10sB. 小于10sC. 等于20sD. 大于20s
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)。下列能说明反应达到平衡状态的是
SO3(g)+NO(g)。下列能说明反应达到平衡状态的是
A. 体系的压强保持不变
B. 混合气体的密度保持不变
C. 混合气体的颜色保持不变
D. 每消耗1molSO3的同时生成1molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料知:Br2的沸点为58.8 ℃,密度为3.119 g·cm-3,微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________态,保存时通常在盛溴的试剂瓶中加入少量________。
Ⅱ.工业生产中,海水提取溴常用热空气吹出法。其生产流程如下:

某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量的Cl2;
④将B中所得液体进行蒸馏,收集液溴。

(2)当观察到A中液面上方出现________(实验现象)时即可判断步骤①中反应已经结束。
(3)X试剂可以是________(填字母,下同),尾气处理选用________。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 d.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为________________________________。
(4)蒸馏时应该选择______(填序号),操作中应控制的关键实验条件为____________。

Ⅲ.该实验小组利用制得的单质溴研究H2与Br2生成HBr的反应,实验装置如下:

(5)E装置可用来检验反应产物HBr,则D装置的作用是_______。若要检验E中收集的HBr,图示装置检验HBr还不够完善,请结合原有实验装置予以改进:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是硫酸工业尾气的主要成分。以硫酸工业的尾气联合制备硫酸钾和硫酸锰晶体(MnSO4·H2O)的工艺流程如下:

(1)反应Ⅰ的总化学方程式为_______________________________。
(2)反应Ⅱ需控制温度在60~70 ℃,其原因是_______________________。实验室控制温度在60~70 ℃的加热方法是________________。
(3)上述生产工艺中可循环使用的物质是________________。
(4)检验硫酸钾样品中是否含有氯化物杂质的实验操作是_______________________。
(5)已知软锰矿浆的主要成分是MnO2,则反应Ⅳ中氧化剂与还原剂的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在强碱性溶液中能大量共存的是
A.Mg2+、Na+、NO3-、SO42-B.Na+、K+、ClO-、I-
C.Na+、K+、HCO3-、SO42-D.Ba2+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物 A(C9H12O)常用于药物及香料的合成,A 有如下转化关系:
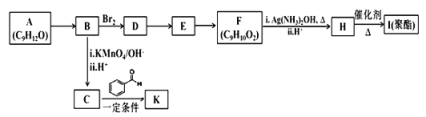
已知以下信息:①A 是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
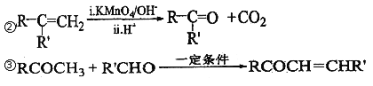
回答下列问题:
(1)B 生成 D 的反应类型为___________,由 D 生成 E 的反应所需的试剂及反应条件为_______。
(2)A 中含有的官能团名称为________________。
(3)K 的结构简式为________________________。
(4)由 F 生成 H 的反应方程式为________________________。
(5)F 有多种同分异构体,符合下列条件的同分异构体有__________种。
①属于芳香族化合物 ②能发生水解反应和银镜反应
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。____________________________
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业含铜废料含有 Cu、CuO、CuS、CuSO4 等成分,利用该含铜废料可生产硝酸铜晶体[Cu(NO3)2·3H2O],生产的工艺流程如图所示,请回答下列问题:
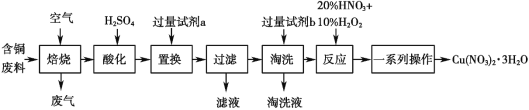
(1)“焙烧”过程中除生成 SO2 的反应外,另外一个反应的化学方程式是______。
(2)“酸化”过程为加快反应速率,可采用的措施有______(写出一条即可)。
(3)若试剂 a 为 Zn,则“置换”的离子方程式为_____。
(4)“淘洗”的作用是_________________。
(5)“反应”一步中使用 20% HNO3 和 10% H2O2,整个过程无红棕色气体产生,则发生反应的离子方程式为_______________________________________;若该步骤只使用 20% HNO3,随着反应的进行,温度升高,出现大量红棕色气体,则还原剂与氧化剂的物质的量之比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com