
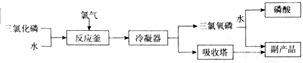
分析 (1)三氯化磷中P为+3价,可水解生成亚磷酸和盐酸;亚磷酸为二元酸;
(2)POCl3中P元素化合价为+5价,可水解生成磷酸和盐酸;
(3)流程中发生PCl3+Cl2+H2O=POCl3+2HCl,以此解答;
(4)根据Ksp[Ca3(PO4)2]=c2(PO43-)×c3(Ca2+)=2×10-29计算;
(5)沉淀中含有氯化银、AgOH以及磷酸银等;
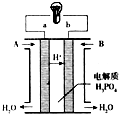
(6)由氢离子移动方向可知a为负极,b为正极,正极发生氧化反应,工作温度较高,反应速率大.
解答 解:(1)三氯化磷中P为+3价,可水解生成亚磷酸和盐酸,方程式为PCl3+3H2O=H3PO3+3HCl,亚磷酸为二元酸,发生H3PO3+2NaOH=Na2HPO3+2H2O,
故答案为:PCl3+3H2O=H3PO3+3HCl;
(2)POCl3中P元素化合价为+5价,可水解生成磷酸和盐酸,则0.1molPOCl3可水解生成0.1mol磷酸、0.3mol盐酸,最多可消耗4mol•L-1NaOH溶液0.6mol,体积为$\frac{0.6mol}{4mol/L}$=0.15L=150mL,故答案为:+5;150;
(3)流程中发生PCl3+Cl2+H2O=POCl3+2HCl,氧化剂为Cl2,还原产物为HCl,还原剂为PCl3,POCl3为氧化产物,则氧化产物与还原产物的物质的量之比为1:2,
故答案为:1:2;
(4)Ksp[Ca3(PO4)2]=c2(PO43-)×c3(Ca2+)=2×10-29,若处理后的废水中c(PO43-)<10-5mol/L,
则c(Ca2+)=$\root{3}{\frac{2×1{0}^{-29}}{(1{0}^{-5})^{2}}}$mol/L=5.85×10-7mol/L,
故答案为:5.85×10-7mol/L;
(5)产品在碱性条件下水解,溶液中存在氢氧根离子以及磷酸根离子,则加入硝酸银,可生成氯化银、AgOH以及磷酸银等,
故答案为:沉淀不仅含有氯化银,还含有氢氧化银、磷酸银;
(6)由氢离子移动方向可知a为负极,b为正极,正极发生氧化反应,电极方程式为CH4-8e-+2H2O=8H++CO2,由于工作温度较高,则反应速率大,
故答案为:负;CH4-8e-+2H2O=8H++CO2;该电池工作温度高.
点评 本题考查较为综合,为高频考点,侧重于学生的分析、实验和计算能力的考查,注意把握实验原理以及物质的性质,为解答类型题目的关键,难度中等.


科目:高中化学 来源: 题型:解答题
 .
. 、
、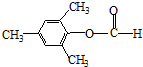 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
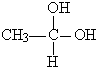 →CH3-CHO+H2O
→CH3-CHO+H2O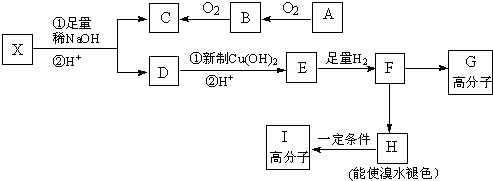
 ;
;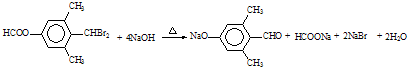 ;
;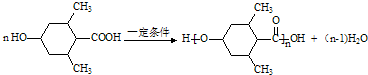 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
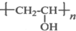 ,其工业合成路线如下:
,其工业合成路线如下: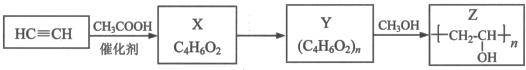
 ;
;
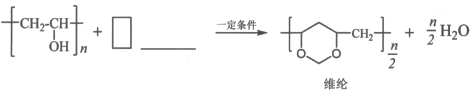
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸稀溶液加水稀释,溶液中所有离子浓度均减小 | |
| B. | NaHC2O4溶液中有:2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| C. | pH=3的草酸与pH=12的NaOH溶液混合至中性时,溶液中有:c(Na+)=c(HC2O4-)+2c(C2O42-) | |
| D. | 等浓度的草酸和碳酸相比,溶液中由水电离出来的c(H+)前者更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2S溶液中:c(Na+)=c(HS-)+c(S2-) | |
| B. | 乙烯的燃烧热为akJ•mol-1(a>0),则乙烯燃烧的热化学方程式可表示为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-akJ•mol-1 | |
| C. | 钢铁发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH- | |
| D. | 从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com