
 | 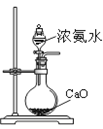 | 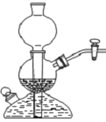 | 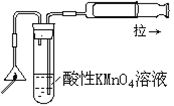 |
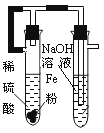
| A.制备Fe(OH)2 | B.制备少量氨气 | C.实验室制备乙炔 | D.检验火柴头燃烧产生的SO2 |
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源:不详 题型:单选题
|
|
|
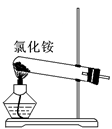
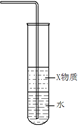
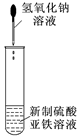
 ① ② ③ ④
① ② ③ ④查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤ | B.②③④ | C.②③⑥ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
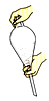
| A.②④⑧ | B.①③⑤ | C.③④⑥ | D.②④⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
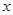 H2O晶体的
H2O晶体的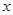 值,数据如下(已知
值,数据如下(已知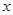 的理论值为5.0):
的理论值为5.0):| 坩埚质量 | 坩埚+试样 | 失水后坩埚+试样 |
| 11.700g | 14.200g | 13.201g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.①④ | C.②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
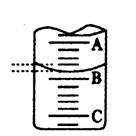
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com