
【题目】某有机物的结构确定:
①测定实验式:某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是 __________________;
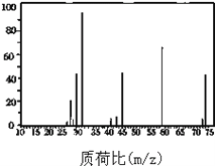
②确定分子式:如图是该有机物的质谱图,则其相对分子质量为 ____;分子式为 _____;
③结构式的确定:经测定,该有机物在核磁共振氢谱中出现四个峰,其氢原子个数比为6∶1∶2∶1;该有机物与金属钠反应产生氢气;则A的结构简式为 _______________。
【答案】C4H10O 74 C4H10O (CH3)2CHCH2OH
【解析】
①碳的质量分数是64.86%,氢的质量分数是13.51%,氧元素质量分数是21.63%,计算出该物质中碳、氢、氧原子个数之比,从而确定实验式;
②根据质谱图知,其相对分子质量是74,结合其实验式确定分子式;
③与金属钠反应产生氢气说明结构中含有羟基或羧基,结合核磁共振氢谱判断该有机物分子的结构简式。
①碳的质量分数是64.86%,氢的质量分数是13.51%,氧元素质量分数是21.63%,则该物质中碳、氢、氧原子个数之比= ![]() ∶
∶![]() ∶
∶![]() =4∶10∶1,所以其实验式为:C4H10O,故答案为:C4H10O;
=4∶10∶1,所以其实验式为:C4H10O,故答案为:C4H10O;
②由质谱图可知,其相对分子质量为74,实验式的式量为74,而12×4+1×10+16×1=74,故其分子式为C4H10O,故答案为:74,C4H10O;
③该有机物在核磁共振氢谱中出现四个峰,其氢原子个数比为6∶1∶2∶1,说明有四种氢,该有机物与金属钠反应产生氢气,说明含羟基,故A的结构简式为;(CH3)2CHCH2OH,故答案为:(CH3)2CHCH2OH。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g)===2NO2(g)△H=-110kJ·mol-1;25℃时,将NO和O2按物质的量之比为2:1充入刚性反应容器中,用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min | 0 | 80 | 160 |
|
p/kpa | 75.0 | 63.0 | 55.0 | 55.0 |
(1)0~80min,v(O2)=_____kPa/min;随着反应进行,反应速率逐渐减小的原因是____。用压强代替浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为____(保留3位有效数字)。
(2)查阅资料,对于总反应2NOg)+O2(g)=2NO2(g)有如下两步历程
第一步2NO(g)====N2O2(g) 快速反应
第二步N2O2(g)+O2(g)=2NO2(g) 慢反应
总反应速率主要由第______步决定;若利用分子捕获器适当减少反应容器中的N2O2,总反应的平衡常数K(p)将___(填“增大”、“减小”或“不变”);若提高反应温度至35℃,则体系压强p∞(35℃)______p∞(25℃)(填“大于”、“等于”或“小于”)。
II.NO的工业处理
(3)H2还原法:2NO(g)+2H2(g)===N2(g)+2H2O(g);△H=a;已知在标准状况,由元素最稳定的单质生成1mol纯化合物时的焓变叫标准摩尔生成焓。NO(g)和H2O(g)的标准摩尔生成焓分别为+90kJ/mol、-280kJ/mol,则a=_____。
(4)O3-CaSO3联合处理法
NO可以先经O3氧化,再用CaSO3水悬浮液吸收生成的NO2,转化为HNO2,则悬浮液吸收NO2的化学方程式为__________;CaSO3水悬浮液中加入Na2SO4溶液能提高SO32-对NO2的吸收速率。请用平衡移动原理解释其主要原因_________________(结合化学用语和文字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含有金属元素的化合物一定是离子化合物
B. 具有共价键的化合物就是共价化合物
C. 由非金属元素形成的化合物一定不是离子化合物
D. 含有离子键的化合物必是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧锂电池材料含有钴酸锂(LiCoO2)、导电剂石墨和铝粉等。回收废旧锂电池中钴的工艺流程如下:
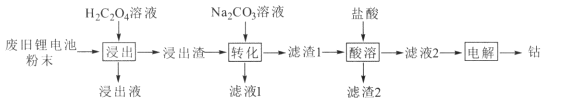
已知:Ksp(CoC2O4)=2.5×10-9,Ksp(CoCO3)=1.5×10-13
回答下列问题:
(1)“浸出液”的主要成分是LiHC2O4、Al(HC2O4)3,“浸出渣”的主要成分是CoC2O4。“浸出”中生成CoC2O4的化学方程式为 _______ ,若H2C2O4用量过大,CoC2O4的产率反而会降低,原因是____。
(2)“转化”中加入Na2CO3溶液发生反应的离子方程式为___________,该反应进行的程度较大,试用平衡常数K解释原因 _____ 。
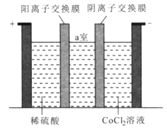
(3)“电解”时装置如图所示。阳极的电极反应式为______,电解后a室中的电解液可返回 ________工序继续使用。
(4)某废旧锂电池粉末中LiCoO2的质量分数为w,将mkg该废料进行回收利用,电解得到钴nkg,钴的回收率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)乙酸乙酯的键线式 _________________;间二甲苯的结构简式 ____________________;![]() 的分子式 ______________________;
的分子式 ______________________;
(2)戊烷(C5H12)的某种同分异构体只有一种一氯代物,该烃的结构简式: __________;
(3)分子式为C4H9Cl的物质,有4种同分异构体,请写出这4种同分异构体的结构简式:___________, __________, __________, _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )

A.1.0 mol/L,20 mL B.0.5 mol/L,40 mL
C.0.5 mol/L,80 mL D.1.0 mol/L,80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的两极分别为Pb、PbO2,电解液为硫酸,工作时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下面结论正确的是
A. Pb为正极,被氧化B. 溶液的pH不断减小
C. SO42-只向PbO2处移动D. 电解液密度不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为_____________________。
(2)两同学利用下图所示装置进行测定:

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为过滤、洗涤、干燥。
②装置E中碱石灰的作用是__________________。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是____(填选项序号,下同)。若未进行步骤____,将使测量结果偏低。
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为____。
(3)丙同学认为还可以通过测量CO2的体积并测量____来测定沉淀中CuCO3的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于取代反应的是( )
A.光照射甲烷与氯气的混合气体B.乙烯通入溴水中
C.在镍做催化剂的条件下,苯与氢气反应D.乙酸溶液中加入纯碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com