
����Ŀ�����û�ѧ��Ӧԭ���о�NH3�����ʾ�����Ҫ���壮��ش��������⣺
��1�����öԱ������ӵ�ؿɼ�ⰱ�������ط�Ӧԭ��Ϊ2NH3+![]() ���Ա������TN2H4+
���Ա������TN2H4+![]() ���Ա��ӣ���N2H4�ĽṹʽΪ �� �õ�������ĵ缫��ӦʽΪ ��
���Ա��ӣ���N2H4�ĽṹʽΪ �� �õ�������ĵ缫��ӦʽΪ ��
��2��25��ʱ����nmolL��1�İ�ˮ��0.1molL��1������������ϣ�
�ٵ������Һ�У�c��NH4+��=c��Cl����ʱ������Һ��pH= ��
�ڵ������Һ�У�c��NH4+����c��Cl����ʱ����Ӧ���������Ϊ ��
a������㣮��ˮʣ�� b����ˮ������ǡ����ȫ��Ӧ c���������
��3����0.5L�����ܱ������У�һ������N2��H2���з�Ӧ��N2��g��+3H2��g��2NH3��g����H=bkJmol��1 �� �仯ѧƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
�¶�/�� | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
��д���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽ�� �� b������ڡ�����С�ڡ����ڡ���0��
��400��ʱ�����ijʱ�̰��������������������ʵ����ֱ�Ϊ3mol��2mol��1molʱ����ʱ�̸÷�Ӧ��v����N2��������ڡ�����С�ڡ����ڡ���v����N2����
��4����֪����4NH3��g��+3O2��g���T2N2��g��+6H2O��g����H=��1266.8kJmol��1
��N2��g��+O2��g���T2NO��g����H=180.5kJmol��1
д�������´��������Ȼ�ѧ����ʽ ��
���𰸡�
��1��![]() ��
��
��2��7��a
��3��![]() ��С�ڣ�С��
��С�ڣ�С��
��4��4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=��905.8KJ/mol
���������⣺��1�������൱�ڰ���������һ����ԭ�ӱ�����ȡ���������µĽṹʽΪ ![]() ���õ��������
���õ�������� ![]() �õ���������
�õ��������� ![]() ���缫��ӦʽΪ��
���缫��ӦʽΪ��  �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��  ����2���ٸ��ݵ���غ�ã�c��Cl����+c��OH����=c��NH4+��+c��H+������Һ��c��Cl����=c��NH4+��������c��OH����=c��H+����������Һ�����ԣ���pH=7�����Դ��ǣ�7���ڸ��ݵ���غ�ã�c��NH4+��+c��H+��=c��OH����+c��Cl��������c��NH4+����c��Cl����ʱ����c��H+����c��OH��������Һ�ʼ��ԣ� a������㣬��ˮʣ�࣬��Һ�Լ��ԣ��������������a��ѡ�� b����ˮ������ǡ�÷�Ӧ�������Ȼ�泥�笠�����ˮ�������ԣ������ⲻ������b��ѡ�� c�������������Һ�����ԣ������ⲻ������c��ѡ�����Դ��ǣ�a����3����N2��g��+3H2��g��2NH3��g����H=bkJmol��1 �� ƽ�ⳣ��K=
����2���ٸ��ݵ���غ�ã�c��Cl����+c��OH����=c��NH4+��+c��H+������Һ��c��Cl����=c��NH4+��������c��OH����=c��H+����������Һ�����ԣ���pH=7�����Դ��ǣ�7���ڸ��ݵ���غ�ã�c��NH4+��+c��H+��=c��OH����+c��Cl��������c��NH4+����c��Cl����ʱ����c��H+����c��OH��������Һ�ʼ��ԣ� a������㣬��ˮʣ�࣬��Һ�Լ��ԣ��������������a��ѡ�� b����ˮ������ǡ�÷�Ӧ�������Ȼ�泥�笠�����ˮ�������ԣ������ⲻ������b��ѡ�� c�������������Һ�����ԣ������ⲻ������c��ѡ�����Դ��ǣ�a����3����N2��g��+3H2��g��2NH3��g����H=bkJmol��1 �� ƽ�ⳣ��K= ![]() ���ɱ������ݿ�֪��ƽ�ⳣ�����¶����߶���С��˵�������¶ȣ�ƽ��������У����������ȷ�Ӧ��������ӦΪ���ȷ�Ӧ����bС��0�����Դ��ǣ�
���ɱ������ݿ�֪��ƽ�ⳣ�����¶����߶���С��˵�������¶ȣ�ƽ��������У����������ȷ�Ӧ��������ӦΪ���ȷ�Ӧ����bС��0�����Դ��ǣ� ![]() ��С�ڣ���400��C N2��g��+3H2��g��2NH3��g����K=0.5��400��ʱ����ð��������������������ʵ����ֱ�Ϊ3mol��2mol��1molʱ��Ũ�ȷֱ�Ϊ
��С�ڣ���400��C N2��g��+3H2��g��2NH3��g����K=0.5��400��ʱ����ð��������������������ʵ����ֱ�Ϊ3mol��2mol��1molʱ��Ũ�ȷֱ�Ϊ ![]() =6mol/L��
=6mol/L�� ![]() =4mol/L��
=4mol/L�� ![]() =2mol/L��Qc=
=2mol/L��Qc= ![]() =1.1��K��˵��ƽ��������У�v����N2����v����N2�������Դ��ǣ�С�ڣ���4����4NH3��g��+3O2��g���T2N2��g��+6H2O��g����H=��1266.8kJmol��1��N2��g��+O2��g���T2NO��g����H=+180.5kJmol��1 �� �ɢ�+2���ڿɵã�4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=����1266.8kJmol��1��+��+180.5kJmol��1��=��905.8KJ/mol�����Դ��ǣ�4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=��905.8KJ/mol��
=1.1��K��˵��ƽ��������У�v����N2����v����N2�������Դ��ǣ�С�ڣ���4����4NH3��g��+3O2��g���T2N2��g��+6H2O��g����H=��1266.8kJmol��1��N2��g��+O2��g���T2NO��g����H=+180.5kJmol��1 �� �ɢ�+2���ڿɵã�4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=����1266.8kJmol��1��+��+180.5kJmol��1��=��905.8KJ/mol�����Դ��ǣ�4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=��905.8KJ/mol��
�����㾫����������Ĺؼ��������⻯ѧƽ��ļ�������֪ʶ�����շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PTT�ǽ�������Ѹ�ٷ�չ���������������Ծ������ϣ������������ܣ�����Ϊ�������ϡ���֯��ά�͵�̺�Ȳ��϶��õ��㷺Ӧ�ã���ϳ�·�߿����Ϊ�� 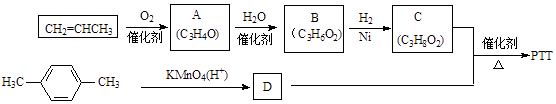
����A��B��C��Ϊ��״�����A�ܷ���������Ӧ��B�в���������ش��������⣺
��1��A��B�Ľṹ��ʽ�ֱ�Ϊ��
��2��д��һ����������������A��ͬϵ��Ľṹ��ʽ
�ٷ���ʽΪC4H6O �ں���1����CH3
��3��1mol C���������Ʒ�Ӧ����L H2����״������
��4��������C��D��Ӧ����PTT�Ļ�ѧ����ʽΪ �� ��Ӧ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ��������������A��B��F����ԭ������֮��Ϊ25����֪B��Fͬ���壬1.8g E�����������ᷴӦ����ECl3��2.24L��������״���£���D+��E�����Ӿ�����ͬ�ĵ��Ӳ�ṹ����ҵ���õ��Ԫ��B��E���γ����ӻ�����ķ���ұ��E���ʣ����жϣ�
��1������Ԫ���зǽ�������ǿ����������ţ�����Ԫ�������ڱ��е�λ��
��2����A��B��D����Ԫ���γɻ�����ĵ���ʽ
��3�������ܹ�˵��B��F�ǽ�����ǿ���ķ�����a������������Ӧˮ��������
b����̬�⻯������ȶ���
c����̬�⻯��ķе�B��F��
d����F����̬�⻯����Һ��ͨ��B���ʣ��л���
��4��д�����з�Ӧ�����ӷ���ʽ����A��B��D��F����Ԫ�ؿ������������ʽ�Σ�д�����������෴Ӧ�����ӷ���ʽ
��д������D������������Ӧˮ������ECl3���Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������(����)
A. ��Һʱ���ȴ��¿ڷų��²�Һ�壬�ٴ��Ͽڵ����ϲ�Һ��
B. ���Թ��еμ�Һ��ʱ����ͷ�ιܽ����Թ��ڱ�
C. ������ƿ��ת��Һ��ʱ���ò���������
D. ����ʱ��©���¶˽����ձ��ڱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������RO ![]() ��R���������·�Ӧ��RO
��R���������·�Ӧ��RO ![]() +5R��+6H+=3R2+3H2O�������й���RԪ�ص�˵������ȷ���ǣ� ��
+5R��+6H+=3R2+3H2O�������й���RԪ�ص�˵������ȷ���ǣ� ��
A.Rλ��Ԫ�����ڱ��еĵ�VA��
B.R���⻯���ˮ��Һ������
C.RO ![]() �е�RԪ��ֻ�ܱ���ԭ
�е�RԪ��ֻ�ܱ���ԭ
D.R2�ڳ��³�ѹ��һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������8��Ԫ�ص����ʡ��������±����У��������ڵڶ���������ڣ�
��� | �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶��10��10m�� | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
�����ͻ��ϼ� | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
��2 | ��3 | ��1 | ��3 |
�ش��������⣺
��1���۵�Ԫ�ط����������Ԫ��������������Ԫ�����ڱ��е�λ������
��2���ȽϢܺ͢ߵ��⻯����ȶ��ԣ��û�ѧʽ��ʾ��
��3���õ���ʽ��ʾ�ں͢���ɵĻ�������γɹ�����
��4��д���ߵ�����������Ӧ��ˮ�����������⻯�����Ӧ�Ļ�ѧ����ʽ
��5��д���ڵ�����������Ӧ��ˮ������ݵ��⻯��ˮ��Һ������Ӧ�����ӷ���ʽ��
��6�������ۡ�ʮ�����˷ɴ�����Ҫһ�ֻ����������պ���Ա������CO2 �� ����Ϊ������Ӧ�����ϱ��е�Ԫ����ɣ�����б�ţ����û�ѧ����ʽ��ʾ����ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������������Ӧ�������ɣ�CH3��2CHCH2CH3 �� ������������ǣ� ��
A.2������2����ϩ
B.2��3��������1����ϩ
C.3������1����ϩ
D.2������1��3������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2.0mol PCl3��1.0mol Cl2�������������ܱ������У���һ�������·���������Ӧ��PCl3(g) + Cl2(g) ![]() PCl5(g)����ƽ��ʱ��PCl5Ϊ0.4mol�������ʱ����1.0mol PCl3��0.5molCl2 ������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ���������
PCl5(g)����ƽ��ʱ��PCl5Ϊ0.4mol�������ʱ����1.0mol PCl3��0.5molCl2 ������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ���������
A. 0.2mol B. 0.4mol C. ����0.2mol����0.4mol D. ��0.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֻ��һ���Լ����Ȼ��ơ��Ȼ������Ȼ��������Ȼ������Ȼ�þ������Һͨ��һ��ʵ����ܼ������������Լ���
A. KSCN B. BaCl2 C. NaOH D. HCl
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com