
 实验室中若用如图所示的装置制取并收集干燥的氨气.
实验室中若用如图所示的装置制取并收集干燥的氨气.分析 实验室用氯化铵和氢氧化钙固体在加热条件下制备氨气,氨气为碱性气体,可用碱石灰干燥,氨气密度比空气小,用向下排空法收集,可用红色石蕊试纸或pH试纸检验,以此解答该题.
解答 解:(1)实验室制备氨气是利用氯化铵和氢氧化钙固体加热生成氯化钙、氨气和水,反应的化学方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O;
(2)生成的氨气中含有水蒸气,氨气是碱性气体,需要通过碱石灰吸收水蒸气,对氨气进行干燥,
故答案为:碱石灰;
(3)氨气为碱性气体,与水反应生成NH3•H2O,电离子出OH-离子,溶液呈碱性,检验时把湿润的石蕊试纸放到试管口,若变红色,说明试管C中生成NH3,氨气和氯化氢反应生成白烟氯化铵,所以也可用玻璃棒蘸取浓盐酸,靠近试管口,若有大量白烟生成,说明试管C中生成NH3,
故答案为:用一湿润的红色石蕊试纸接近试管口,若试纸变蓝则为氨气.
点评 本题考查了氨气的制备和性质的检验,为高频考点,侧重于学生的分析能力和实验能力的考查,明确氨气制备原理和性质是解题关键,注意氨气和铵盐的检验方法,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molCl2 与过量乙烷在光照下反应,生成的有机物中含有氯原子的总数为2NA | |
| B. | 1molC3H8 中含有的共用电子对数为11NA | |
| C. | 1.5g 甲基含有的质子数和电子数之和为1.8NA | |
| D. | 标况下,11.2 L癸烷含有的原子个数为16 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素可形成卤化物、叠氮化物及络合物等.
氮元素可形成卤化物、叠氮化物及络合物等.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
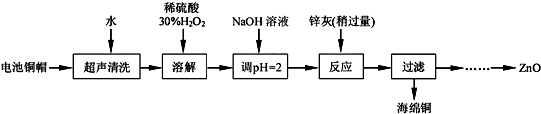
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
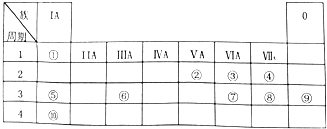
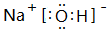 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.C原子结构示意图
B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.C原子结构示意图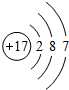
 ,结构式
,结构式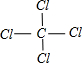 ,中心原子Asp3杂化,立体构型是非极性 (填“极性”或“非极性”)分子.
,中心原子Asp3杂化,立体构型是非极性 (填“极性”或“非极性”)分子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com