
| A. | NH4+、Cu2+、SO42-、NO3- | B. | Mg2+、Fe2+、NO3-、I- | ||
| C. | K+、Na+、Al3+、SO42- | D. | K+、Na+、SO32-、S2- |
分析 强酸性溶液中存在大量氢离子,强碱性溶液中存在大量氢氧根离子,
A.四种离子之间不反应,都不与氢离子反应;
B.镁离子、亚铁离子与氢氧根离子反应,硝酸根离子在酸性条件下能够氧化碘离子;
C.四种离子之间不反应,都不与氢离子反应;
D.四种离子之间不发生反应,都不与氢氧根离子反应.
解答 解:强酸性溶液中存在大量氢离子,强碱性溶液中存在大量氢氧根离子,
A.NH4+、Cu2+、SO42-、NO3-之间不发生反应,都不与氢离子反应,在强酸性溶液中能够大量共存,故A错误;
B.Mg2+、Fe2+能够与氢氧根离子反应,NO3-、I-之间在酸性条件下发生氧化还原反应,在强酸性或强碱性溶液中都不能大量共存,故B正确;
C.K+、Na+、Al3+、SO42-之间不发生反应,都不与氢离子反应,在强酸性溶液中能够大量共存,故C错误;
D.K+、Na+、SO32-、S2-之间不反应,都不与氢氧根离子反应,在强碱性溶液中能够大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量相等的N2和C2H4 | B. | 等体积的CO和CO2 | ||
| C. | 等温等体积的O2和N2 | D. | 等压等体积的N2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与Cu2O的物质的量之比为2:1 | |
| B. | 沉淀为氢氧化铜 | |
| C. | 产生的NO在标准状况下的体积为4.48 L | |
| D. | Cu、Cu2O与硝酸恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨烯是一种比钢铁更强韧的新型材料 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 道尔顿提出了原子论、门捷列夫提出了分子论 | |
| D. | 无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
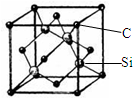 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、KCl和Na2SO4 | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用加热法鉴别Na2CO3和NaHCO3两种固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com