
【题目】实验室中某些气体的制取、收集及尾气处理装里如图所示(省略了净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
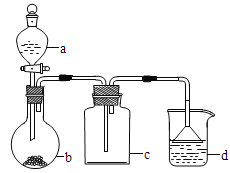
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 氯化按 | NaOH | NH3 | H2O |
B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,有关该有机物的叙述不正确的是( )
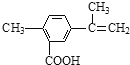
A.在一定条件下,能发生取代、氧化、酯化和加聚反应
B.该物质分子中最多可以有11个碳原子在同一平面上
C.1 mol该物质最多可与4 mol H2发生加成反应
D.1 mol该物质完全氧化最多可消耗14mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 元素周期律是元素原子核外电子排布周期性变化的结果
B. HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C. 第三周期非金属元素含氧酸的酸性从左到右依次增强
D. 形成离子键的阴、阳离子间只存在静电吸引力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
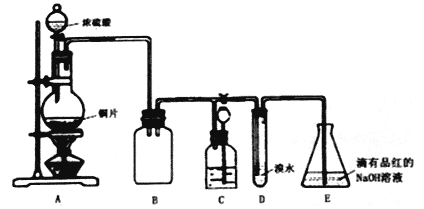
(1)装置A中发生反应的化学方程式是____________,装置B的作用是____________。
(2)设计装置D的目的是验证SO2的_____________性,E中NaOH全部转化为NaHSO3的标志是____________。
(3)装置C的作用是贮存多余的气体,C中应放置的液体是________。
(4)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到目的是________(填序号);
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液pH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(5)向E瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
② | 滴加少量棕红色的KI3溶液,振荡 | II | |
③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
④ | 加入几小块CaCO3固体 | 有气泡产生 |
(6)请设计简单实验证明室温下HSO3-的电离平衡常数Ka与水解平衡常教Kb的相对大小_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯的结构简式可以表示为CH2CH2
B.苯、乙醇和乙酸都能发生取代反应
C.丙烯所有原子可能在一个平面上
D.水煤气和天然气的主要成分都是甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)为确定某铝热剂(含氧化铁Fe2O3和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体体积为6.72L(标准状况)。反应的离子方程式是________ _____ ;样品中铝的质量是____ ___g。
(2)若另取a g样品将其加热引燃,恰好完全反应,该反应的化学方程式是________________,则a为________________ g。
(3)待(2)中反应产物冷却后,加入足量盐酸,反应的离子方程式为 和
,同时生成的气体在标准状况体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )


A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是短周期界素中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出Z在元素周期表中的位置为第 周期、第 族。
(2)气体分子YW2的电子式为 。
(3)由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为 。
(4)在一定条件下,由X单质与单质Z可化合生成E,工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式 。该反应中被氧化的E与参与反应的E的质量之比 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺(NH2Cl)、二氯胺(NHCl2)和三氯胺(NCl3)。氯胺消毒时首先发生水解,生成具有强烈杀菌作用的次氯酸。
(1)NH2Cl中氯元素的化合价为___________,其电子式为__________。
(2)NH2Cl水解的离子方程式为____________。
(3)三氯胺在常温下为黄色黏稠的油状液体,有毒,在弱酸性溶液中稳定性较好。将0.01 mol NCl3通入100mL0.5mol/LNa2S03溶液中,转移电子的物质的量为___________。
(4)己知:2NH3(g)+3C12(g)=N2(g)+6HCl(g)△H1=-469kJ/mol
N2(g)+3C12(g)=2NC13(g) △H2=+520kJ/mol
NH3(g)+3C12(g)= NC13(g)+ 3HCl(g)△H3
则△H3=__________kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com