
| A、电负性:F>O>N |
| B、第一电离能:Mg>Al>Na |
| C、结合质子能力:OH-<CH3COO-<Cl- |
| D、稳定性:H2O>H2S>H2Se |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
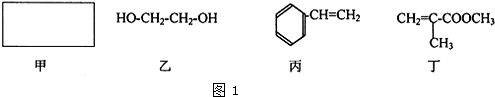

查看答案和解析>>
科目:高中化学 来源: 题型:
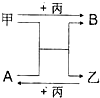 甲、乙、丙是三种单质,A、B是两种化合物,它们相互间有如图转化关系.请回箸下列问题:
甲、乙、丙是三种单质,A、B是两种化合物,它们相互间有如图转化关系.请回箸下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
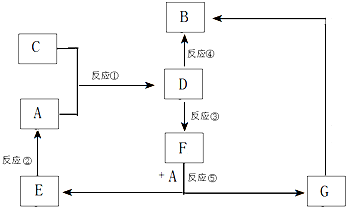 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 | (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
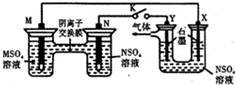 在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )| A、左装置中溶液c(M2+)减小 |
| B、N和X的电极反应式均为:N2++2e-=N |
| C、Y电极上有O2产生,发生还原反应 |
| D、若M电极转移了0.4mol电子,则y电极生成2.24L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电路中共转移0.9mol电子 |
| B、阳极得到的气体中有O2且其物质的量为0.35mol |
| C、阴极质量增加3.2g |
| D、若改用铜棒做电极电解该溶液,电极反应不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com