
| A. | N2和H2在点燃或光照条件下可合成氨 | |
| B. | 氨气是弱电解质 | |
| C. | 工业上可使用液氨作制冷剂 | |
| D. | 由氨制取硝酸过程中,氮元素被还原 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-Cl- Na+ H+ | B. | K+ Na+ SO42- Ba2+ | ||
| C. | Cl- Na+ Ag+ NO3- | D. | CO32- SO42- Cl- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4=2H++SO42- | B. | Ba(OH)2=Ba2++2OH- | ||
| C. | Na2CO3=2Na+1+CO3-2 | D. | NaHCO3=Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
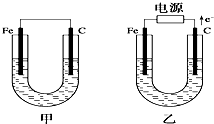 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (a-b) mL | B. | (25-a)mL | C. | (b-a)mL | D. | 大于a mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧能对水体消毒,是因为其能杀死水中的病菌 | |
| B. | 执行“限塑令”主要是为了节约资源 | |
| C. | 含磷洗涤剂因为其易被细菌分解,所以不会导致水体污染 | |
| D. | 新装修的住房中放置任何花卉都能降低居室中甲醛的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com