
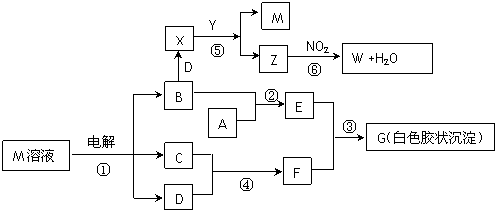
 ŅŃÖŖĻĀĶ¼ÖŠĪļÖŹMŹĒÓÉĶ¬Ņ»¶ĢÖÜĘŚµÄĮ½ÖÖŌŖĖŲ×é³ÉµÄĄė×Ó»ÆŗĻĪļ£¬ŃęÉ«·“Ó¦ĪŖ»ĘÉ«£¬ŅõĄė×ÓŌŖĖŲ×īøßÕż¼ŪÓėĖüµÄøŗ¼Ū“śŹżŗĶĪŖ6”£X¾ßÓŠĘư׊Ō£¬YĪŖ¼īŠŌĘųĢ壬 WŹĒ¶ŌæÕĘųĪŽĪŪČ¾µÄĘųĢ唣ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
ŅŃÖŖĻĀĶ¼ÖŠĪļÖŹMŹĒÓÉĶ¬Ņ»¶ĢÖÜĘŚµÄĮ½ÖÖŌŖĖŲ×é³ÉµÄĄė×Ó»ÆŗĻĪļ£¬ŃęÉ«·“Ó¦ĪŖ»ĘÉ«£¬ŅõĄė×ÓŌŖĖŲ×īøßÕż¼ŪÓėĖüµÄøŗ¼Ū“śŹżŗĶĪŖ6”£X¾ßÓŠĘư׊Ō£¬YĪŖ¼īŠŌĘųĢ壬 WŹĒ¶ŌæÕĘųĪŽĪŪČ¾µÄĘųĢ唣ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öµē½āMČÜŅŗ¢ŁµÄ»Æѧ·½³ĢŹ½ ”£
£Ø2£©Š“³öŹµŃéŹŅÖĘČ”YĘųĢåµÄ»Æѧ·½³ĢŹ½ ”£
£Ø3£©ČōAŹĒŅ»ÖÖ³£¼ū½šŹō£¬Š“³ö·“Ó¦¢ŚµÄ»Æѧ·½³ĢŹ½ ”£
£Ø4£©ČōAŹĒijŌŖĖŲµÄŅ»ÖÖ³£¼ūĖįŠŌŃõ»ÆĪļ£¬Š“³ö·“Ó¦¢ŪµÄĄė×Ó·½³ĢŹ½ ”£
£Ø5£©Š“³öXµÄµē×ÓŹ½ ŗĶZµÄ½į¹¹Ź½ ”£
£Ø6£©Š“³ö·“Ó¦¢ŻµÄ»Æѧ·½³ĢŹ½ ”£
£Ø7£©±ź×¼×“æöĻĀ·“Ó¦¢ŽÖŠÉś³É11.2L WŹ±×ŖŅʵĵē×ÓŹż ”££ØÓĆNA±ķŹ¾°¢·š¼ÓµĀĀŽ³£Źż£©
 Č«³Ģ½š¾ķĻµĮŠ“š°ø
Č«³Ģ½š¾ķĻµĮŠ“š°ø æģĄÖ5¼Ó2½š¾ķĻµĮŠ“š°ø
æģĄÖ5¼Ó2½š¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚ”°ĀĢÉ«»Æѧ”±¹¤ŅÕÖŠ£¬ĄķĻėדĢ¬ŹĒ·“Ó¦ÖŠŌ×ÓČ«²æ×Ŗ»ÆĪŖÓūÖĘµÄ²śĪļ£¬¼“Ō×ÓĄūÓĆĀŹĪŖ100£„”£ŅŌĻĀ·“Ó¦×ī·ūŗĻĀĢÉ«»ÆѧŌ×Ó¾¼ĆŅŖĒóµÄŹĒ
A. ŅŅĻ©¾ŪŗĻĪŖ¾ŪŅŅĻ©øß·Ö×Ó²ÄĮĻ B. ¼×ĶéÓėĀČĘųÖʱøŅ»ĀČ¼×Ķé
C. ŅŌĶŗĶÅØĻõĖįĪŖŌĮĻÉś²śĻõĖįĶ D. ÓƶžŃõ»Æ¹čÖʱøøß“æ¹č
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ±ä»Æ¹ż³Ģ£¬ŹōÓŚ·ÅČČ·“Ó¦µÄŹĒ(””””)
¢ŁŅŗĢ¬Ė®±ä³ÉĖ®ÕōĘų””¢ŚĖį¼īÖŠŗĶ·“Ó¦””¢ŪÅØH2SO4Ļ”ŹĶ””¢Ü¹ĢĢåNaOHČÜÓŚĖ®””¢ŻH2ŌŚCl2ÖŠČ¼ÉÕ””¢ŽŹ³ĪļøÆ°Ü
A£®¢Ś¢Ū¢Ü¢Ż¢Ž B£®¢Ś¢Ū¢Ü C£®¢Ś¢Ż¢Ž D£®¢Ł¢Ū¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijĻ”ĮņĖįŗĶĻ”ĻõĖįµÄ»ģŗĻČÜŅŗ200 mL£¬Ę½¾ł·Ö³É Į½·Ż£¬ĻņĘäÖŠŅ»·ŻÖŠÖš½„¼ÓČėĶ·Ū£¬×ī¶ąÄÜČܽā19.2 g£ØŅŃÖŖĻõĖįÖ»Äܱ»»¹ŌĪŖNOĘųĢ壩”£ĻņĮķŅ»·ŻÖŠÖš½„¼ÓČėĢś·Ū£¬²śÉśĘųĢåµÄĮæĖęĢś·ŪÖŹĮæŌö¼ÓµÄ±ä»ÆČēĶ¼ĖłŹ¾”£ĻĀĮŠ·ÖĪö»ņ½į¹ū“ķĪóµÄŹĒ
A£®Ō»ģŗĻŅŗÖŠNO3-µÄĪļÖŹµÄĮæĪŖ0.2mol
B£®OA¶Ī²śÉśŹĒNO£¬AB¶Ī·“Ó¦ĪŖ2Fe3++Fe = 3Fe2+£¬BC¶Ī²śÉśĒāĘų
C£®ČÜŅŗÖŠ×īÖÕČÜÖŹĪŖFeSO4
D£®c(H2SO4)ĪŖ5mol”¤L£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚŅ»ĆܱÕČŻĘ÷ÖŠÓŠCO”¢H2”¢O2¹²16£®5gŗĶ×ćĮæµÄNa2O2£¬ÓƵē»š»ØŅżČ¼£¬Ź¹ĘäĶźČ«·“Ó¦£¬Na2O2ŌöÖŲ7£®5g£¬ŌņŌ»ģŗĻĘųĢåÖŠO2µÄÖŹĮæ·ÖŹżŹĒ
A£® 54£®5% B£®40% C£®36% D£®33£®3%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
³±ŹŖµÄĀČĘų”¢ŠĀÖʵÄĀČĖ®”¢“ĪĀČĖįÄĘ”¢ĘÆ°×·ŪČÜŅŗ¾łÄÜŹ¹ÓŠÉ«²¼ĢõĶŹÉ«£¬ÕāŹĒÓÉÓŚĖüĆĒŗ¬ÓŠ»ņÄÜÉś³É £Ø £©
A£®ĀČĘų B£®“ĪĀČĖį C£®“ĪĀČĖįøł D£®ĀČ»ÆĒā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
0.5LµÄFe2(SO4)3ČÜŅŗÖŠFe3+µÄÅضČĪŖ0.2mol/L,Óė0.2L0.5mol/LµÄNa2SO4ČÜŅŗÖŠSO42-µÄÅضČÖ®±ČŹĒ£Ø £©
A.3£ŗ2 B.2£ŗ5 C.3£ŗ5 D.5£ŗ3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

A£®4£3£2£1 B£®1£2£3£4
C£®3£4£2£1 D£®1£2£4£3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚ25 ”ꏱ£¬Ļņ100 mLŗ¬ĀČ»ÆĒā14.6 gµÄŃĪĖįČÜŅŗĄļ·ÅČė5.6 g“æĢś·Ū£Ø²»æ¼ĀĒ·“Ó¦Ē°ŗóČÜŅŗĢå»żµÄ±ä»Æ£©£¬·“Ó¦æŖŹ¼ÖĮ2 minÄ©ŹÕ¼Æµ½ĒāĘų1.12 L£ØŅŃ»»ĖćĪŖ±ź×¼×“æö£©£¬ŌŚ“ĖÖ®ŗó£¬ÓÖ¾¹ż4 min£¬Ģś·ŪĶźČ«Čܽā”£Ēó£ŗ
£Ø1£©ŌŚĒ°2 minÄŚÓĆFeCl2±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹ£»
£Ø2£©ŌŚŗó4 minÄŚÓĆHCl±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹ£»
£Ø3£©Ē°2 minÓėŗó4 minĻą±Č£¬·“Ó¦ĖŁĀŹÄÄøö½Ļæģ£æ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com