
| A. | 水 | B. | 氨水 | C. | 醋酸 | D. | 氯化钠 |
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C3H8 | C. | C4H8 | D. | C5H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3 NA | |
| C. | 0.2 mol Cl2与足量的铁粉充分反应,转移电子数为0.6NA | |
| D. | 标准状况下,11.2 L 氯仿所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
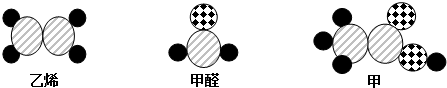
| A. | 物质甲的分子式为C2H4O2 | |
| B. | 若物质甲具有酸性,则乙烯和甲醛一定具有酸性 | |
| C. | 物质甲、乙烯和甲醛分子都具有双键 | |
| D. | 若三种物质在空气中完全燃烧,生成的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl=K++Cl- | B. | H2CO3?2 H++CO32- | ||
| C. | H2SO4=2H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水跟盐酸反应:OH-+H+→H2O | |
| B. | 铁与硝酸银溶液反应:Fe+Ag+→Fe2++Ag | |
| C. | 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+→Cu2++2H2O | |
| D. | 氢氧化钡跟稀硫酸反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入3mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入3mL 5% H2O2溶液和3mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
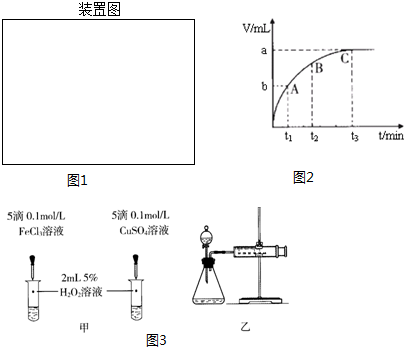
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com