
请利用氧化还原反应 设计一个原电池.
设计一个原电池.
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年昆明三中、滇池中学高一下期中考试化学卷(滇中)(带解析) 题型:填空题
理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池(正极材料用碳棒),回答下列问题:
该电池的电解质溶液是 ;负极发生 反应(填“氧化”或“还原”),电极反应式
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江永嘉县普高联合体高一下学期期中联考化学试卷(解析版) 题型:填空题
(14分)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用 “Cu+2Ag+ =2 Ag +Cu2+ ” 反应设制一个化学电池,如图所示,已知该电池在外电路中,电流从a极流向b极。 请回答下列问题:
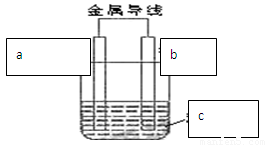
(1)b极是电池的 极,材料是 ,该极上出现的现象是 ,写出该电极的反应式 。
(2)a可能为
A、铜 B、银 C、铁 D、石墨
(3)c溶液是
A、CuSO4溶液 B、AgNO3溶液 C、酒精溶液
(4)若该反应过程中有0.2mol电子发生转移,则生成Ag为 克。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省台州市高一下学期期末考试化学 题型:填空题
(14分)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用 “Cu+2Ag+ =2 Ag +Cu2+ ” 反应设制一个化学电池,如图所示,已知该电池在外电路中,电流从a极流向b极。 请回答下列问题:

(1)b极是电池的 极,材料是 ,该极上出现的现象是 ,写出该电极的反应式 。
(2)a可能为
A、铜 B、银 C、铁 D、石墨
(3)c溶液是
A、CuSO4溶液 B、AgNO3溶液 C、酒精溶液
(4)若该反应过程中有0.2mol电子发生转移,则生成Ag为 克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com