
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S=CuS↓+2H+
C.Zn2++S2-+2H2O= Zn(OH)2↓+H2S↑
D.FeS+2H+=Fe2++H2S↑
科目:高中化学 来源: 题型:
在1 L HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol/l,向该溶液中加入足量铜粉,加热,充分反应,当HNO3与H2SO4的物质的量比为x:y 时所得溶液中Cu2+物质的量浓度最大,则x:y为
A.2:3 B.3:8 C.1:4 D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) 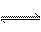 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为元素周期表中短周期的一部分,下列说法正确的是

A.非金属性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.三种元素中,Y的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)
反应II: CO2(g) + 3H2(g) CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)
上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
则CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=
(3)某实验小组依据甲醇燃烧的反应原理,设计如下左图所示的电池装置。
①该电池负极的电极反应为 。
②工作一段时间后,测得溶液的pH (填增大、不变、减小)。
③用该电池作电源,组成如下右图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/LCuSO4溶液,乙容器装300mL饱和NaCl溶液,写出c电极的电极反应 ,常温下,当300mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为 mL(标准状况) ,电解后向甲中加入适量下列某一种物质 ,可以使溶液恢复到原来状态,该物质是 (填写编号) 。
A.CuO B.CuCO3 C.Cu(OH)2 D.Cu2(OH)2CO3

查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向容积为2L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g)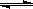 2SO3(g)的平衡常数为( )
2SO3(g)的平衡常数为( )
A.400mol-1·L B.800mol-1·L
C.1600mol-1·L D.3200mol-1·L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0. 10 mol/L NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3=Na++ H++ CO32-
B.25℃时,加水稀释后,n(H+)与n( OH-)的乘积变大
C.离子浓度关系:c( Na+)+c(H+)=c( OH-)+c( HCO3- )+c( CO32-)
D.温度升高,c(HCO3-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A. 久置的氯水与新制的氯水,都能使有色布条褪色
B. 氯气、液氯和氯水是同一种物质
C. 碘化钾溶液中加淀粉溶液变蓝色
D. 加碘盐就是在食盐中加入适量的碘酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是

A.甲装置:可用来证明硫的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法能检查此装置的气密性
D.丁装置:可在瓶中先装入某种液体收集NO气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com