
【题目】![]() 代表阿伏加德罗常数的值,下列叙述正确的是( )
代表阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,![]() 三氧化硫中所含分子数约为
三氧化硫中所含分子数约为![]()
B.![]() 溶液中含有的钾离子数目为
溶液中含有的钾离子数目为![]()
C.![]() 盐酸与足量
盐酸与足量![]() 共热,转移的电子数为
共热,转移的电子数为![]()
D.常温下,![]() 固体
固体![]() 中,含有的阴阳离子总数为
中,含有的阴阳离子总数为![]()
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置能达到目的的是( )
A | B | C | D |
|
|
|
|
混合浓硫酸和乙醇 | 配制一定浓度的溶液 | 收集 | 证明乙炔可使溴水褪色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是重要的有机化工原料。实验室主要用浓硫酸或浓磷酸作催化剂使醇脱水制取烯烃。某同学使用环己醇脱水制备环己烯。设计方案如下:
(一)主要仪器和试剂
仪器:50mL圆底烧瓶、分馏柱、直形冷凝管、10mL量筒、分液漏斗、100mL锥形瓶、蒸馏头、接液管。
试剂:10.0g(10.4mL,0.1mol)环己醇、5mL浓磷酸、氯化钠、无水氯化钙、5%碳酸钠水溶液。
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
化学物质 | 相对分子 质量 | 相对密度/ g·cm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.96 | 161.1 | 稍溶于水 |
磷酸(85%) | 98 | 1.83 | 213 | 易溶于水 |
环己烯 | 82 | 0.89 | 83.3 | 微溶于水 |
(三)实验流程


请回答:
(1)加热过程中,若忘记加沸石,应如何操作?___
(2)将粗产品分去水层所需要用到的主要实验仪器是___。
(3)本实验用浓磷酸代替浓硫酸的优点:___。
(4)该实验的主要副产物为___(填物质名称)。
(5)在提纯环己烯时,用等体积的饱和食盐水,而不用水的原因是___。加入3~4mL5%碳酸钠溶液的目的是___。
(6)水浴蒸馏最后得到7.0g产品,则反应的产率为___(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】30 mL1 mol·L-1NaCl溶液和40 mL0.5 mol·L-1CaCl2溶液混合后,混合液中Cl-浓度为(假设溶液体积混合前后不变)( )
A.0.5 mol·L-1B.0.6 mol·L-1C.1.0 mol·L-1D.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、三种元素,已知C原子最外层电子数为次外层电子数的3倍;B和C原子核外电子层数相等,而最外层电子数之和为10;A、C能形成AC型化合物,A2+离子和B原子电子层数也相同。回答:
(1)画出A2+离子的结构示意图 _____________________;
(2)A、B、C三元素符号分别为___________ 、_____________ 、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以![]() 和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物,该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物,该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A.![]() 的还原性强于金刚石B.另一种化合物是
的还原性强于金刚石B.另一种化合物是![]()
C.纳米级金刚石粉末可以透过半透膜D.这个反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含下表离子中的几种,且各离子的物质的量浓度相等(不考虑水的电离与离子水解)。
阳离子 | K+、NH4+、Fe2+、Mg2+、Cu2+ |
阴离子 | OH-、Cl-、CO32-、SO42- |
某同学进行了如下实验(必要时可加热):
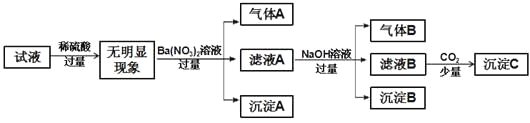
下列说法正确的是
A. 由沉淀A推断原溶液中一定含有SO42-
B. 原溶液中只含有NH4+、Fe2+、Cl-、SO42-
C. 滤液A中可能含有K+
D. 沉淀B中一定含有Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
Ⅰ.现有下列10种物质:①熔融的氢氧化钠②蔗糖③盐酸④金属钠⑤硫酸⑥二氧化硫⑦硫粉⑧石膏![]() ⑨酒精溶液⑩液氨
⑨酒精溶液⑩液氨
(1)属于电解质的是_______________(填序号,下同)。
(2)属于非电解质的是_____________。
(3)上述状态下能导电的是__________。
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示。请回答下列问题:
84消毒液
[有效成分]![]()
[规格]![]()
[质量分数]25%
[密度]![]()
(1)![]() 的物质的量浓度约为________
的物质的量浓度约为________![]() (保留两位有效数字)。
(保留两位有效数字)。
(2)某同学参阅该“84消毒液”的配方,欲用![]() 固体配制
固体配制![]() 含
含![]() 质量分数为25%的消毒液。下列说法正确的是___________(填字母)。
质量分数为25%的消毒液。下列说法正确的是___________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
![]()
![]()
![]()

![]()
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量![]() 固体的质量为
固体的质量为![]()
E.配制过程中,定容时俯视刻度线会使得溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH =a kJmol-1能量变化如图所示。下列说法中正确的是
2SO3(g) ΔH =a kJmol-1能量变化如图所示。下列说法中正确的是

A.a=E3-E1
B.逆反应的活化能大于a kJmol-1
C.过程②使用催化剂降低活化能,从而改变反应的焓变
D.将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出的热量等于a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com