
(12分)(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体(分子式为CH4·9H2O),则356g“可燃冰”释放出的甲烷燃烧,生成液态水时能放出1780.6 kJ的热量,则甲烷燃烧的热化学方程式可表示为:_______________________________。
(2) 在100℃时,将0.100mol的N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到下表数据:

①从表中分析:该反应的平衡常数为___________;
②在上述条件下,60s内N2O4的平均反应速率为_____________;
③达平衡后下列条件的改变可使NO2浓度增大的是_________。
A.增大容器的容积 B.再充入一定量的N2O4
C.再充入一定量的NO2 D.再充入一定量的He
(3)常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液,消耗盐酸的体积分别为V1、V2,则V1_____V2(填“>”“<”或“=”下同);
②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,消耗盐酸的体积分别为V3、V4,则V3_____V4;
③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,最后溶液均为中性,消耗盐酸的体积分别为V5、V6,则V5_____V6。
(1)CH4(g) +2O2 (g)→CO2(g)+2H2O(l);△H=-890.3 kJ/mol;
(2) ① 0.36; ② 0.001 mol/(L·s); ③B、C; (3)>; =; <。
【解析】
试题分析:(1)356g“可燃冰”的物质的量是356g÷178g/mol=2mol。则其中含有的甲烷的物质的量是2mol,能放出1780.6 kJ的热量,则1mol的甲烷完全燃烧产生稳定的化合物时所放出的热量是1780.6 kJ÷2mol=890.3 kJ. 甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2 (g)→CO2 (g)+2H2O(l);△H=-890.3 kJ/mol; (2) ①从表中分析:该反应达到平衡时N2O4的平衡浓度是0.04mol/L、NO2平衡浓度是0.12mol/L,则反应的平衡常数为K ;②在上述条件下,60s内N2O4的平均反应速率为v(N2O4)=
;②在上述条件下,60s内N2O4的平均反应速率为v(N2O4)= ; ③A.增大容器的容积,NO2浓度减小,错误;B.再充入一定量的N2O4,即增大反应物的浓度,平衡正向移动,NO2浓度增大,正确;C.再充入一定量的NO2,平衡逆向移动,但是平衡移动消耗量远小于加入量,所以NO2浓度增大,正确;D.再充入一定量的He,对平衡无影响,NO2浓度不变,错误。(3)因为一水合氨是弱碱,NaOH是强碱,所以常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液时,由于n(NH3·H2O)>n(NaOH);消耗盐酸的体积分别为V1、V2,则V1>V2。②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,因为二者的物质的量相等,所以消耗盐酸的体积也相等,因此V3=V4;③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,若都恰好中和,则前者产生的是强酸弱碱盐,水解使溶液显酸性,所以若最后溶液均为中性,消耗盐酸的体积要略小写,因此V5<V6。
; ③A.增大容器的容积,NO2浓度减小,错误;B.再充入一定量的N2O4,即增大反应物的浓度,平衡正向移动,NO2浓度增大,正确;C.再充入一定量的NO2,平衡逆向移动,但是平衡移动消耗量远小于加入量,所以NO2浓度增大,正确;D.再充入一定量的He,对平衡无影响,NO2浓度不变,错误。(3)因为一水合氨是弱碱,NaOH是强碱,所以常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液时,由于n(NH3·H2O)>n(NaOH);消耗盐酸的体积分别为V1、V2,则V1>V2。②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,因为二者的物质的量相等,所以消耗盐酸的体积也相等,因此V3=V4;③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,若都恰好中和,则前者产生的是强酸弱碱盐,水解使溶液显酸性,所以若最后溶液均为中性,消耗盐酸的体积要略小写,因此V5<V6。
考点:考查热化学方程式的书写、化学平衡常数、化学反应速率的计算、酸碱中和反应时体积关系的计算。


科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
使1 mol 丙烯(结构简式为CH3—CH=CH2)与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照条件下发生完全取代反应,则两个过程中消耗氯气总的物质的量是
A.8mol B.7mol C.6 mol D.5 mol
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高二化学试卷(解析版) 题型:选择题
下列各组物质中,所含元素的质量分数相同,但它们既不属于同分异构体,也不属于同系物的是
A.乙烯 丙烯 B.异戊二烯 3?甲基?1?丁炔 C.甲烷 乙烯 D.苯 苯乙烯
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:选择题
元素Y的原子获得3个电子或元素X的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确化学式是
A.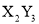 B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:填空题
(16分)(1)某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1 mol。
①烃A的分子式为 。
②若取一定量的A完全燃烧后,生成B、C各3 mol,则有 g烃A参加了反应。
③若烃A不能使溴水褪色,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,则A的结构简式为 。
④若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为 ;
其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为 。
(2).在有机物:①CH3CH3、②CH2=CH2、③CH3CH2C≡CH、④CH3C≡CCH3、⑤C2H6;⑥CH3CH=CH2中,
一定互为同系物的是 ,
一定互为同分异构体的是 。(填编号)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
一定温度下,某密闭容器里发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
①升高温度 ②增大压强
③再通入n mol CO2和n mol H2 ④再加入2n mol CO和2n mol H2O(g)
A.①② B.②④ C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
下列热化学方程式中,ΔH能正确表示物质的燃烧热的是( )
A.CO(g)+1/2O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
B.C(s)+1/2O2(g)====CO(g) ΔH=-110.5 kJ·mol-1
C.H2(g)+1/2O2(g)====H2O(g) ΔH=-241.8 kJ·mol-1
D.2C8H18(l)+25O2(g)====16CO2(g)+18 H2O(l) ΔH=-11036 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:填空题
(8分)(1)某温度时,在2 L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示。由图中数据分析,该反应的化学方程式为:____________________________
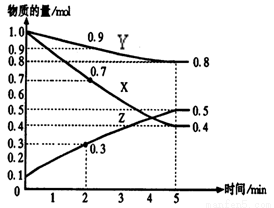
(2) 用Z表示从0—2min内该反应的平均反应速率为
____________________
(3) 某时刻t(t﹤5min)测得Y、Z两者的物质的量之比为
3:1,则X的转化率为_________
(4) 该条件下,能说明反应已达到平衡状态的是
a.容器内z物质的量浓度为0.25mol/L
b.正反应和逆反应的速率都为0
c.容器内X、Y、Z物质的量之比为1∶3∶2
d.容器内X气体的体积分数不变
e. 单位时间内消耗3a mol X,同时生成2a mol Z
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2  2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法错误的是
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法错误的是
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2不可能100%地转化为SO3
C.为了提高SO2的转化率,应适当提高O2的浓度
D.达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com