
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500 ℃时,10 mol SO2和6 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和5 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应xkb1.com
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲
科目:高中化学 来源: 题型:
医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—103.0%),工艺流程为:
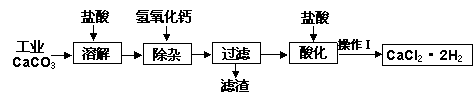
生产二水合氯化钙的主要流程
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:① ,
②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 (只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因
之一为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:① 1molH2分子中化学键断裂时需要吸收436kJ的能量、② 1molCl2分子中化学键断裂时需要吸收243kJ的能量、③ 由H原子和Cl原子形成1molHCl分子时释放431kJ的能量。下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)===2HCl(g)
B.氢气与氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气与氯气反应生成2mol氯化氢气体,反应的△H=—183kJ/mol
D.氢气与氯气反应生成1mol氯化氢气体,反应的△H=—183kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
对于固定体积的密闭容器中进行的气体反应可以说明A(g) + B(g) C(g)+D(g)在恒温下已达到平衡的是( )
C(g)+D(g)在恒温下已达到平衡的是( )
A.反应容器的压强不随时间而变化 B.A气体和B气体的生成速率相等
C.A、B、C三种气体的生成速率相等 D.反应混合气体的密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)一定量的A、B在2 L的密闭容器中进行反应A(g)+B(g)  2C(g),2 min后,测得各物质的浓度分别为c(A)=0.5 mol/L,c(B)=0.75 mol/L,c(C)=0.5 mol/L,则A和B起始的物质的量分别为A:____________ 和B:____________ 。
2C(g),2 min后,测得各物质的浓度分别为c(A)=0.5 mol/L,c(B)=0.75 mol/L,c(C)=0.5 mol/L,则A和B起始的物质的量分别为A:____________ 和B:____________ 。
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)===xC(g)+2D(g),经过5 min后测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol/(L·min),A在5 min末的浓度是____ ,B的平均反应速率是__ _,x的值为
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应为3H2+N2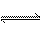 2NH3,其反应速率可以分别为v(H2)、v(N2)、v(NH3)[mol·(L·s)-1]表示,则正确的关系式为( )
2NH3,其反应速率可以分别为v(H2)、v(N2)、v(NH3)[mol·(L·s)-1]表示,则正确的关系式为( )
A.v(H2)=v(N2)=v(NH3) B.3v(H2)=v(N2)
C.v(NH3)=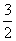 v(H2) D.v(H2)=3v(N2)
v(H2) D.v(H2)=3v(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
阅读下列材料后回答问题:一个体重50Kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+ 的转化时,实现①的转化需消耗 剂(填氧化或还原),

Fe3+
通常用 (填试剂名称)检验Fe3+存在。
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作 剂,Fe3+发生 反应。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CO(g)+Cl2(g)  COCl2(g) ΔH<0,当反应达到平衡时,下列措施中能提高Cl2转化率的是
COCl2(g) ΔH<0,当反应达到平衡时,下列措施中能提高Cl2转化率的是
①升温 ②降温 ③增加CO浓度 ④加压 ⑤加催化剂 ⑥恒压通入惰性气体
A.①②④ B.①④⑥ C.②③④ D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com