
 2014年诺贝尔物理学奖得主的贡献是发明了一种高效而环保的光源--蓝色发光二极管(LED).某同学对此非常感兴趣,请你帮助某同学完成资料收集的工作.
2014年诺贝尔物理学奖得主的贡献是发明了一种高效而环保的光源--蓝色发光二极管(LED).某同学对此非常感兴趣,请你帮助某同学完成资料收集的工作.分析 (1)碳化硅晶体属于原子晶体;
(2)金刚石晶体中,碳原子所连接最小的环含有6个碳原子,碳化硅晶体中最小的环含有6个原子,且C、Si原子数目之比为1:1;
每个C原子形成4个C-Si键,任意2个C-Si决定2个六元环,4个C-Si键有6种组合;
(3)碳化硅中,碳原子形成4个C-Si键,杂化轨道数目为4,C原子与周围的4个Si原子形成正四面体结构;
(4)电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量;
(5)镓在元素周期表的位置是:第四周期ⅢA族;
(6)第一电离能越大,越不容易失去电子,磷砷化镓或磷化镓中没有H原子,掺杂N原子不能形成氢键;
(7)由图可知,其他条件相同时,当电流小于153.0 mA时,氮化镓绿色LED光强随着电流的增加而增强,当电流大于153.0 mA时,光强随着电流的增强而减弱.
解答 解:(1)碳化硅晶体属于原子晶体,故答案为:原子;
(2)金刚石晶体中,碳原子所连接最小的环含有6个碳原子,碳化硅晶体中最小的环含有6个原子,且C、Si原子数目之比为1:1,则在碳化硅晶体中,碳原子所连接最小的环由3个碳原子和3个硅原子组成,每个C原子形成4个C-Si键,任意2个C-Si决定2个六元环,4个C-Si键有6种组合,所以每个碳原子连接2×6=12 个这样的环,
故答案为:3;3;12;
(3)碳化硅中,碳原子形成4个C-Si键,杂化轨道数目为4,C原子采取sp3杂化,C原子与周围的4个Si原子形成正四面体结构,键角为:109°28’,
故答案为:sp3;109°28’;
(4)电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,
故答案为:电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量;
(5)镓在元素周期表的位置是:第四周期ⅢA族,其基态原子的价电子排布式为4s24p1,
故答案为:第四周期ⅢA族;4s24p1;
(6)A.氮的半径比磷和砷的半径小,用氮代替部分磷或砷的位置不会影响晶体的构型,可能正确;
B.N的第一电离能大于磷和砷,不容易失去电子,故不可能正确;
C.磷砷化镓或磷化镓中没有H原子,掺杂N原子不能形成氢键,不可能正确;
N的电负性大,掺杂后得到的位置中存在氢键.
D.N是与砷、磷具有相同价电子结构的杂质,N引导电负性较大,但对电子束缚能力较磷和砷强,造成等电子陷阱,可能正确,
故选:BC;
(7)由图可知,其他条件相同时,当电流小于153.0 mA时,氮化镓绿色LED光强随着电流的增加而增强,当电流大于153.0 mA时,光强随着电流的增强而减弱,
故答案为:其他条件相同时,当电流小于153.0 mA时,氮化镓绿色LED光强随着电流的增加而增强,当电流大于153.0 mA时,光强随着电流的增强而减弱.
点评 本题考查晶胞结构、杂化方式、结构与位置关系等,属于拼合型题目,(6)中为易错点、难点,注意利用排除法解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=-242kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
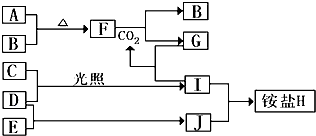
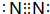 和
和 .
.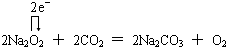 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和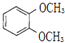 不属于同分异构体的 不属于同分异构体的 | |
| B. | 质量相同的C3H6 和C2H6完全燃烧时消耗氧气的质量较少的是C3H6 | |
| C. | 连接四个不同基团的碳原子为“手性碳原子”,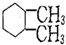 含有两个手性碳原子 含有两个手性碳原子 | |
| D. | 标准状况下22.4 L溴乙烷所含化学键总数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | 氨水与盐酸反应:OH-+H+=H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.067mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com