
����ʵ�����������ͽ��۾���ȷ���ǣ� ��
ѡ�� | ʵ����� | ���� | �� |
A | �ֱ����Na2CO3��NaHCO3���� | �Թ��ڱڶ���ˮ�� | �������ʾ����ȷֽ� |
B | ��ϡ�ı���ˮ��Һ�еμӱ�����ˮ | ���ɰ�ɫ���� | �������屽�Ӳ�����ˮ |
C | ��I������ɫ��Һ�еμ�����������ˮ���ٵμӵ�����Һ | ������ۺ���Һ�����ɫ | ��ԭ�ԣ�Cl�� > I�� |
D | ��FeSO4��Һ���ȵ���KSCN��Һ�ٵμ�H2O2��Һ | ����H2O2����Һ���Ѫ��ɫ | Fe2+�������������л�ԭ�� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ˮ�������ķ��Ӻ������� 
��NH4+ ��H2O ��NH3 ��NH3��H2O ��H�� ��OH��
A���٢ڢ� B���ڢۢܢ� C���ڢۢܢݢ� D���٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�찲��ʡ��ɽ�и������¿�����ѧ���������棩 ���ͣ�ʵ����
ij��ѧ��ȤС��ͬѧչ����Ư����������(NaClO2)���о���
ʵ��I����ȡNaClO2����
��֪��NaClO2������Һ���¶ȵ���38 ��ʱ�����ľ�����NaClO2��3H2O������38 ��ʱ�����ľ�����NaClO2������60 ��ʱNaClO2�ֽ��NaClO3��NaCl����������ͼ��ʾװ�ý���ʵ�顣

��1�� װ�â۵������� ��
��2�� װ�â��в���ClO2�Ļ�ѧ����ʽΪ ��װ�â����Ʊ�NaClO2�Ļ�ѧ����ʽΪ ��
��3�� ��װ�âܷ�Ӧ�����Һ���NaClO2����IJ����������£�
�� ��ѹ��55 �������ᾧ���� ���ȹ��ˣ��� ���� ����60 �����õ���Ʒ��
ʵ��II���ⶨij����������Ʒ�Ĵ���
�������ʵ�鷽����������ʵ�飺
�� ȷ��ȡ��������������Ʒm g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ����֪��ClO2�� + 4 I�� + 4 H+ = 2 H2O + 2 I2 + Cl�����������û��Һ���250 mL������Һ��
����ȡ25.00mL������Һ����ƿ�У��Ӽ��ε�����Һ����cmol��L��1Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ����ƽ��ֵΪVmL����֪��I2+2S2O32��=2I��+S4O62������
��4�� �ﵽ�ζ��յ�ʱ������Ϊ ��
��5�� ����Ʒ��NaClO2����������Ϊ ���ú�m��c��V�Ĵ���ʽ��ʾ����
��6�� �ڵζ�������ȷ���������£���ʵ���ý��ƫ�ߣ�ԭ�������ӷ���ʽ��ʾΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�찲��ʡ��ɽ�и������¿�����ѧ���������棩 ���ͣ�ѡ����
Cyrneine A��������ϵͳ�������źܺõ���Ч����������ͪ�����ಽ��Ӧ�ϳɣ� ������˵������ȷ���ǣ� ��
������˵������ȷ���ǣ� ��
A������ͪ�ķ���ʽΪC10H14O
B��Cyrneine A���Է����ӳɷ�Ӧ����ȥ��Ӧ��������Ӧ
C������ͪ��Cyrneine A����ʹ����KMnO4��Һ��ɫ
D��������ͪ��Ϊͬ���칹�壬��������4�ֲ�ͬ��ѧ��������ԭ�ӵķ�����ﹲ��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������һ�и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
2Zn(OH)2��ZnCO3���Ʊ�����ZnO���м��壬��п��ɰ����Ҫ�ɷ�ΪZnO��������Cu2��Mn2+�����ӣ�Ϊԭ���Ʊ�2Zn(OH)2��ZnCO3�Ĺ����������£�
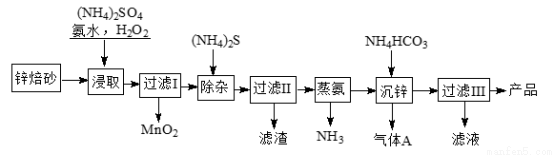
��ش��������⣺
��1����(NH4)2SO4��NH3��H2O�Ļ����Һ�д���c(NH4+)��2c(SO42?)ʱ����Һ�� ����ᡱ��������С����ԡ�
��2������ȡ��ʱΪ�����п�Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ�� ����д���֣���
��3������ȡ��ʱ�����NH3��H2O����������MnO2�����ӷ���ʽΪ ��
��4������S2?�ܽ�Cu2+�����������ȥ����ѡ��ZnS���г��ӣ��Ƿ���У��ü���˵��ԭ�� ��
[��֪��Ksp(ZnS)��1.6��10?24��Ksp(CuS)��1.3��10?36��һ����Ϊ��Ӧ��ƽ�ⳣ��K��105���÷�Ӧ���л�����ȫ��]
��5������п�������ӷ���ʽΪ___________________��
��6�����������ж����Ҫ���ˣ�ʵ���ҽ��й��˲�����Ҫ�õ��IJ���������__________��������III��������Һ��ѭ��ʹ�ã���Ʒ��ϴ�Ӹ�����ã������Ʒϴ�Ӹɾ��IJ�����������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
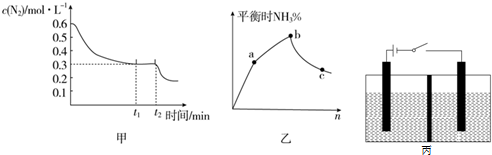
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com