
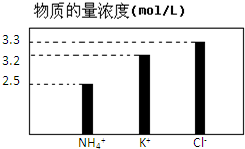
 在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )
在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )| A、2、64、24 |
| B、16、50、24 |
| C、32、50、12 |
| D、64、2、24 |
| 1 |
| 2 |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A | CH3CH3+Cl2
CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 | ||
| B | 由油脂得到甘油; 由淀粉得到葡萄糖 | 均发生了水解反应 | ||
| C | Cl2+2Br?═2Cl?+Br2; Zn+Cu2+═Zn2++Cu | 均为单质被还原的置换反应 | ||
| D | 2Na2O2+2H2O+4NaOH+O2↑;Cl2+H2O═HCl+HClO | 均为水作还原剂的氧化还原反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A、原子半径:X>W>Y |
| B、Y、Z的阴离子电子层结构都与R原子的相同 |
| C、W的氢化物比X的氢化物稳定 |
| D、Y元素的最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、多食用海产品可防治缺铁性贫血 |
| B、食物可调节人体细胞中的酸碱平衡 |
| C、为了减肥,我每天只吃水果、蔬菜 |
| D、我国应该禁止使用食物防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向0.1 mol/L醋酸溶液中加入少量醋酸钠溶液,溶液的pH增大 |
| B、向0.1 mol/L醋酸溶液中加入少量NaOH溶液,溶液中c(CH3COO-)减少 |
| C、向0.1 mol/L醋酸溶液中不断加水,溶液中c(H+)增大 |
| D、向0.1 mol/L醋酸溶液中滴入少量浓盐酸,溶液的导电性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
C、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,读取滴定管末读数时,仰视刻度线 |
| B、测定硫酸铜晶体中结晶水含量的实验时,加热时间过短未完全变白 |
| C、中和滴定时,加待测液前锥形瓶内有少量水 |
| D、测定1mol氢气体积的操作中,反应结束后未抽气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com