
| A. | 向某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的气体,该溶液中一定含有CO32- | |
| B. | 向某溶液中滴加氯水,再加入KSCN溶液,溶液变红,该溶液中一定含有Fe2+ | |
| C. | 向某溶液中通入Cl2后,溶液变黄,继续加淀粉溶液,溶液变蓝,说明原溶液中有I- | |
| D. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
分析 A.溶液中含有亚硫酸根离子和盐酸反应生成的二氧化硫也可以使澄清石灰水变浑浊;
B.向某溶液中先加KSCN无明显现象,再滴氯水溶液变红是检验亚铁离子检验方法,不能先滴加氯水;
C.根据加入淀粉溶液后溶液变蓝,说明溶液中碘单质生成,证明原溶液中含有碘离子;
D.该溶液中一定含有钠离子,可能为氢氧化钠,不一定为盐溶液.
解答 解:A.溶液中含有亚硫酸根离子和盐酸反应生成的二氧化硫也可以使澄清石灰水变浑浊,不一定是碳酸根离子,故A错误;
B.向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红是检验亚铁离子检验方法,若先滴加氯水,无法证明原溶液中是否含有铁离子,则无法判断溶液中是否含有亚铁离子,故B错误;
C.加入淀粉溶液后溶液变蓝,说明溶液中有碘,再根据某无色溶液中通入Cl2后溶液变为黄色,可知原溶液中含有I-,故C正确;
D.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,则该溶液一定含有钠离子,可能为NaOH溶液,不一定是钠盐溶液,故D错误;
故选C.
点评 本题考查常见离子的检验方法,题目难度中等,涉及物质的性质、离子的检验等知识,注意熟练掌握常见离子的性质及检验方法,D为易错点,注意不一定为盐,可能为氢氧化钠溶液.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 元素形成的简单离子的半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X 的强 | |
| C. | X 的最简单气态氢化物的热稳定性比Z的小 | |
| D. | Z位于元素周期表中第2 周期、第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | $\stackrel{23}{11}$Na | ||
| C. | 1s22s22p63s1 | D. | 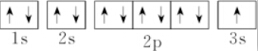 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com