
| 温度 | 溶质质量分数 | 有无催化剂(MnO2) | |
| A | 25℃ | 5% | 有 |
| B | 25℃ | 5% | 无 |
| C | 40℃ | 10% | 有 |
| D | 40℃ | 10% | 无 |
| A、A | B、B | C、C | D、D |
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2H2O=HCl+HClO |
| B、2F2+2H2O=4HF+O2 |
| C、2Na+2H2O=2NaOH+H2↑ |
| D、CaO+H2O=Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与氯化铁溶液:2Fe3++Fe═3Fe2+ |
| B、碳酸钙与盐酸:CO32-+2H+═CO2↑+H2O |
| C、二氧化硅与氢氧化钠溶液:SiO2+2OH-═SiO32-+H2O |
| D、铜与稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2+CuO═Cu+H2O |
| B、Na2 O+H2O═2 NaOH |
| C、CaCO3═CaO+CO2↑ |
| D、KOH+HNO3═KNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下4.48L氧气 |
| B、11g二氧化碳气体(CO2的摩尔质量是44g?mol-1) |
| C、0.5mol氨气 |
| D、含NA个氢分子的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
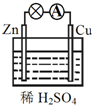 关于如图所示的原电池,下列说法正确的是( )
关于如图所示的原电池,下列说法正确的是( )| A、负极发生还原反应 |
| B、电子由锌片通过导线流向铜片 |
| C、该装置能将电能转化为化学能 |
| D、铜片上发生的反应为Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿| 实验 序号 |
温度℃ | 初始CCl4浓度 (mol?L-1) |
初始H2浓度(mol?L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com