
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
分析 (1)弱酸根质量水解程度越大,相同浓度的钠盐溶液的pH越大,则酸根离子结合质子能力越大;
(2)NaAlO 2溶液中的偏铝酸根离子水解生成偏铝酸和氢氧化钠;
(3)酸或碱抑制了水的电离,含有弱离子的盐促进水电离,据此对各选项进行判断;
(4)任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
(5)0.2mol/LHCl与0.1mol/L NaAlO2溶液等体积混合,设体积都为1L,反应后生成Al(OH)3和Al3+.
解答 解:(1)弱酸根质量水解程度越大,相同浓度的钠盐溶液的pH越大,则酸根离子结合质子能力越大,根据溶液pH知,CO32-的水解程度最大,则CO32-结合质子能力最强,故答案为:CO32-;
(2)NaAlO2为强碱弱酸盐,水解呈碱性,反应的离子方程式为AlO2-+2H2O?Al(OH)3+OH-,加热促进水解,最终产物仍为NaAlO2,
故答案为:AlO2-+2H2O?Al(OH)3+OH-;NaAlO2;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,0.1mol?L-1的CH3COONa溶液的pH=8.8,则溶液中水电离出的c(OH-)=10-5.2mol/L,
A.氢氧化钠抑制水电离,与醋酸钠溶液中水电离程度不等,故A错误;
B.pH=5.2的NH4Cl溶液中水电离出的c(H+)=10-5.2mol/L,与醋酸钠溶液中水电离程度相等,故B正确;
C.盐酸抑制水电离,所以与醋酸钠溶液中水电离程度不等,故C错误;
D.0.1mol/L的NaCN溶液中的pH=11.1,则水电离的c(OH-)=10-2.9mol/L,故D错误;
E.pH=8.8的Na2CO3溶液中水电离出c(OH-)=10-5.2mol/L,与醋酸钠溶液中水电离程度相等,故E正确;
故选BE;
(4)A.混合液中满足物料守恒,根据物料守恒得:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故A错误;
B.根据物料守恒得:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故B正确;
C.根据电荷守恒可得:①c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),根据物料守恒得:②2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),根据①②可得:c(HCO3-)+3c(H2CO3)+2c(H+)=c(CO32-)+2c(OH-),故C错误;
D.混合液中一定满足电荷守恒,根据电荷守恒得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D正确;
E.碳酸根离子水解程度大于碳酸氢根离子,碳酸根离子和碳酸氢根离子都水解导致溶液呈碱性,但水解程度较小,所以溶液中离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故E正确;
F.碳酸根离子水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),碳酸根离子和碳酸氢根离子都水解导致溶液呈碱性,则c(OH-)>c(H+),故F错误;
故选BDE;
(5)0.2mol/LHCl与0.1mol/L NaAlO2溶液等体积混合,设体积都为1L,反应后生成Al(OH)3和Al3+,其中Al3+为$\frac{1}{3}$mol,Al3+水解呈酸性,离子浓度大小顺序为c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-).
点评 本题以盐类水解为载体考查了离子浓度大小比较,题目难度中等,试题题量较大,知识点较多,根据相同浓度钠盐溶液碱性强弱确定酸根离子水解程度大小,再结合守恒思想分析解答,注意明确溶液酸碱性与溶液pH的关系.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
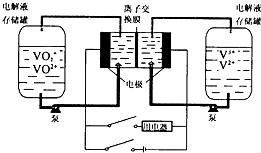
| A. | 充电时阴极的电极反应是V3++e-=V2+ | |
| B. | 放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被被氧化 | |
| C. | 若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol | |
| D. | 若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:| A. | 溶液中一定含有NH4+、C032- | |
| B. | 溶液中离子浓度c(Na+)=c(S042一) | |
| C. | 溶液中一定不含Mg2+、Al3+、Fe3+ | |
| D. | 溶液可能是由Na2C03与(NH4)2S04组成的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3和NxOy都属于酸性氧化物 | |
| B. | 实验室制取氯气时,先加热二氧化锰,后滴入浓盐酸 | |
| C. | 锶与镁、钙、钡同族,由于碳酸钙和碳酸钡都难溶,所以碳酸锶也难溶 | |
| D. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中通入少量SO2:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| B. | 漂白粉中滴加浓盐酸加热制取氯气:ClO-+Cl-+2H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Cl2+H2O | |
| C. | 将0.1mol•L-1的NH4Al(SO4)2溶液与0.2mol•L-1的Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═AlO2-↓+2BaSO4↓+2H2O | |
| D. | 含0.4molFeI2的溶液中通入0.3mol氯气:4Fe2++2I-+3Cl2═4Fe3++I2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
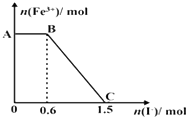
| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.25 mol | |
| D. | 若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Na | Cu | Al | Fe | |
| 熔点 | 97.5℃ | 1083℃ | 660℃ | 1535℃ |
| 沸点 | 883℃ | 2595℃ | 2200℃ | 3000℃ |
| A. | Cu和Na | B. | Fe和Cu | C. | Cu与Al | D. | Al与Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com