
【题目】曲酸和脱氧曲酸是非常有潜力的食品添加剂具有抗菌抗癌作用,其结构如图所示。下列有关叙述不正确的是

A. 曲酸的分子式为C6H6O4
B. 与脱氧曲酸互为同分异构体的芳香族化合物有4种(不考虑—O—O—键)
C. 曲酸和脱氧曲酸均能使酸性高锰酸钾溶液褪色
D. 脱氧曲酸能发生加成反应和酯化反应
科目:高中化学 来源: 题型:
【题目】化学反应原理在生活及工业中运用广泛。
(1)氮氧化物排放是形成臭氧层空洞重要成因之一,氮氧化物破坏臭氧层原理为:i. NO+O3![]() NO2+O2 K1 ii. NO2+O
NO2+O2 K1 ii. NO2+O![]() NO+O2 K2
NO+O2 K2
则反应O3+O![]() 2O2 的平衡常数K=_____(用K1、K2表示)。NO在该反应过程中的作用是_______。
2O2 的平衡常数K=_____(用K1、K2表示)。NO在该反应过程中的作用是_______。
(2)N2H4是火箭发射的助燃剂。N2H4与氨气相似,溶于水生成弱碱N2H4·H2O,写出N2H4·H2O的电离方程式___________。
(3)已知t ℃时,KW=1×10-13,则t ℃_______25℃(填“>”、“<”或“=”)。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
Ⅰ.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌。
②过滤,并用浓HNO3洗涤滤渣。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH至7~8,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)步骤②用浓HNO3洗涤滤渣的目的是_________。
(2)步骤③中肼(N2H4)将过量铬酸(CrO3)还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式_______________。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100L锅炉水(含氧气8g/L)的溶解氧,需要肼的质量为_________。
Ⅱ.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)_________(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )
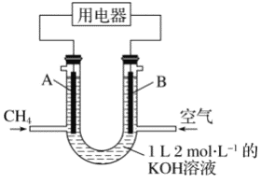
A. OH-由A端移向B端
B. V=33.6L时,溶液中的溶质为KHCO3
C. 0<V≤22.4L时,电池总反应的化学方程式为CH4+2O2+KOH===KHCO3+2H2O
D. 22.4L<V≤44.8L时,负极电极反应为CH4-8e-+9CO![]() +3H2O===10HCO
+3H2O===10HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
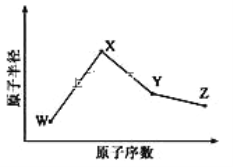
(1)X 元素位于元素周期表中位置为_____________。
(2)X 的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。 Z 所在族的简单氢化物中,沸点最高的是________(写化学式),原因为_________________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为________;X2W2的电子式为___________________。
(4)Y 与 Z 形 成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为_____________。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________________。
(6)在 25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态, 平均每转移 1mol 电子放热 190kJ, 该反应的热化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃) Ag2SO4:0.796 g
(1)甲同学的实验如表:
序号 | 操作 | 现象 |
实验Ⅰ | 将2mL 1 molL-1 AgNO3溶液加入到1mL 1 molL-1 FeSO4溶液中 | 产生白色沉淀,随后又有黑色固体产生 |
取上层清液,滴加KSCN溶液 | 溶液变红 |
注:经检验黑色固体为Ag。
①白色沉淀的化学式是__________________。
②甲同学得出Ag+氧化了Fe2+的依据是_____________________________________。
(2)乙同学为探究Ag+和Fe2+的反应,进行实验II。
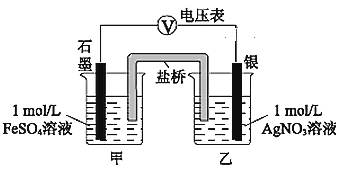
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
①盐桥中盛有饱和KNO3溶液,此盐桥中钾离子向________(填“甲”或“乙”)池移动;
②若该电池能维持稳定电流强度为1 A,工作600s,理论上Ag电极的质量会________(填“增重”或“溶解”) ________g(已知F=96500 C·mol-1,电量(C)=电流(A)×时间(s) )。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
③a中甲烧杯里的电极反应式是______________。
④b中电压表指针逆向偏移后,银为_______(填“正”或“负”)极。
(3)由上述实验得出的结论为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石灰石和稀盐酸制取CO2的反应中,能影响该反应速率的条件是( )
A. 盐酸的体积 B. 盐酸的浓度
C. 石灰石颗粒的大小 D. 溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种第二代抗组胺药物的中间体G的合成路线如下:
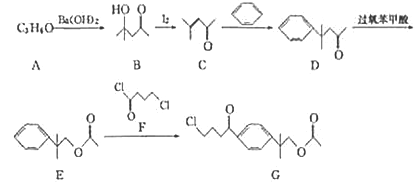
已知:A的分子结构中含有2个甲基。
回答下列问题:
(1)A的名称为__________,由A生成B的反应类型为_______。
(2)G中含氧官能团名称为_______。
(3)F的分子式为_______。
(4)由C生成D的化学方程式为______________。
(5)对二取代芳香化合物W是E的同分异构体,W能发生银镜反应和水解反应,水解产物之一能与FeCl3溶液发生显色反应,则W有________种结构,其中核磁共振氢谱为五组峰,且峰面积之比为1:2 : 2 : 2:9的结构简式为_____________。
(6)参照上述合成路线,以乙醛为原料(无机试剂任选),设计正丁醇的合成路线:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏联科学家欧巴林教授在其著作中曾说:“生命起源于甲烷”,英国科学家巴纳尔教授则认为生命是从二氧化碳和水开始的。与之相关的转化关系如图所示(部分反应条件已略去):

(1)A的结构式为________;C中官能团的电子式为________;反应②的反应类型为________。
(2)写出下列物质的结构简式:D________;H________。
(3)C→D的化学方程式为__________;二氧化碳和水经光合作用生成葡萄糖的化学方程式为_________。
(4)在自然界中纤维素与水可在甲烷菌的催化作用下生成甲烷和二氧化碳,写出该反应的化学方程式并配平:
_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com