
| A. | BeCl2 | B. | CO2 | C. | HCl | D. | N2 |
分析 对于ABn型共价化合物中元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,H原子最外层一定不满足8电子结构,据此判断.
解答 解:A.BeCl2中,Be原子的最外层电子为:2+2=4,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故A不选;
B.CO2中O元素化合价为-2,O原子最外层电子数为6,所以2+6=8,O原子满足8电子结构,C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,C原子满足8电子结构,故B正确;
C.HCl中Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,H元素化合价为+1,H原子最外层电子数为1,所以1+1=2,H原子不满足8电子结构,故C不选;
D.N2中,N与N原子之间有3个共用电子对,则N原子的最外层电子为5+3=8,满足8电子稳定结构,但属于单质,故D正确;
故选BD.
点评 本题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:
根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题:
如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 Na2CO3溶液中,含CO${\;}_{3}^{2-}$数目小于NA | |
| B. | 1mol FeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目为NA | |
| C. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| D. | 1mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接与油污反应 |
| B | 常温下,在足量的浓、稀硝酸中分别加入相同的铝片,浓硝酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 | 乙酸乙酯是非电解质,它不能导电,它的水解产物乙酸是电解质(弱酸) |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含Cu2+的溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
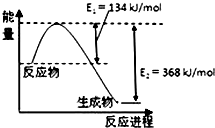 氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com