
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为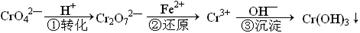
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
| A.Cr2O72—和CrO42—的浓度相同 | B.v正(Cr2O72—) ="2v" 逆(CrO42—) |
| C.溶液的颜色不变 | D.溶液的pH值不变 |
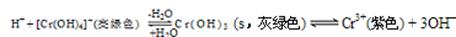
(1)橙
(2)C D
(3)Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O
(4)溶液由紫色变为亮绿色; c(Na+)>c(OH--)>c(SO42--)>c([Cr(OH)4]-)>c(H+) 。
(5)Cr3+、Cr2O72— 。
解析试题分析:
(1)第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O,当平衡体系的pH=2,溶液显酸性,平衡正向移动,所以c(Cr2O72—)较大,则溶液显橙色。
Cr2O72—(橙色)+H2O,当平衡体系的pH=2,溶液显酸性,平衡正向移动,所以c(Cr2O72—)较大,则溶液显橙色。
(2)当反应达到平衡状态时,任何微粒的浓度都保持不变。对每种微粒来说消耗的浓度与产生的浓度相等,即V(正)=V(逆)。溶液的颜色不变,溶液的pH不变,v正(Cr2O72—) ="1/2v" 逆(CrO42—).但不同的微粒的浓度可能相等,也可能不等。因此能说明第①步反应达平衡状态的是C、D。
(3)根据电荷守恒、原子守恒及电子守恒定律可知:第②步中Cr2O72-转变为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
(4)现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液时,c(Cr3+)="0." 1mol/L,n(Cr3+)="0.005mol" ,c(OH-)=0.3mol/L,溶液的pH>4.6所以会发生反应Cr3++3OH-=Cr(OH)3↓, 反应消耗OH-的物质的量为0.015mol,剩余OH-的物质的量为0.3mol/L×0.1L- 0.015mol=0.015mol,c(OH-)="0.015mol" ÷0.1L=0.15mol/L.大于pH=13时的c(OH-)。所以会再发生 Cr(OH)3+ H2O=H++ [Cr(OH)4]2-。因此溶液呈亮绿色。即溶液的颜色由紫色变为亮绿色。c(SO42-)=0.075mol/L,n(Na+)="0.3mol/L," c(OH--)=(0.03mol-4×0.005mol)÷0.1L="0.1mol/L" , c(H+)=Kw÷c(OH--)=10-14÷0.1=10-13mol/L, c([Cr(OH)4]-)=" 0.05mol/L" 。所以溶液中离子浓度由大到小的顺序为c(Na+)>c(OH--)>c(SO42--)>c([Cr(OH)4]-)>c(H+)。
(5)在Na[Cr(OH)4] 溶液中加入H2SO4酸化由关系式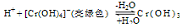
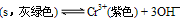 可知铬元素以Cr3+形式存在;在Na2Cr2O7的溶液中加入H2SO4酸化,由:2CrO42—(黄色)+2H+
可知铬元素以Cr3+形式存在;在Na2Cr2O7的溶液中加入H2SO4酸化,由:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O知铬元素以Cr2O72—存在。所以在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以Cr3+、Cr2O72— 形式存在。
Cr2O72—(橙色)+H2O知铬元素以Cr2O72—存在。所以在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以Cr3+、Cr2O72— 形式存在。
考点:考查化学平衡状态的判断、平衡移动、离子浓度的大小比较、离子方程式的书写的知识。


科目:高中化学 来源: 题型:填空题
(10分)某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。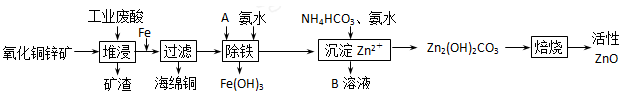
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。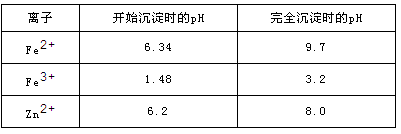
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的 。
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH-、NO3—、SO42— |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)D中干燥管中出现的现象是 ,化学方程式 。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂 。
(5)还有什么方法能证明氧化性Cl2>S ,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH、Ba2+、Al3+、Fe3+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 序号 | 实验内容 | 实验结果 |
| 1 | 加过量盐酸 | 无气体产生 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积),并有红褐色沉淀生成,将沉淀过滤洗涤、干燥、灼烧,称重得1.60 g固体。 |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量 | 第一次称量读数为2.33 g |
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。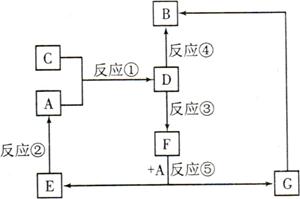
已知:
A为金属单质,B为红褐色固体,E为密度最小的气体,G为浅绿色的溶液。
D的水溶液为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
在水溶液中D能将某氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)构成C物质的元素在周期表中的位置是 ,在短周期主族元素中,该元素与其相邻元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)D的水溶液呈 性,请用离子方程式解释原因: 。
(3)上述反应中属于置换反应的是 (填序号)。
(4)反应③(即D将某种氧化物氧化为F)的离子方程式: 。
(5)对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023个。请按照要求填空:
| 实验步骤 | 实验现象 | 写离子方程式 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 色 | |
| 继续通入气体 | 溶液逐渐变成无色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 __。
(2)检验溶液B中是否存在Fe3+的方法是 __。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | 氨水物质的量浓度/(mol·L-1) | 盐酸物质的量浓度/(mol·L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
食盐和工业用盐具有广泛的用途。已知工业用盐主要成分为NaNO2,外观酷似食盐并有咸味。NaNO2有氧化性和还原性,遇酸分解放出NO2。
(1)下列试剂可鉴别工业用盐和食盐的是________。
a.H2O b.硝酸酸化的硝酸银 c.盐酸
(2)NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为______________。
(3)某工厂废液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2中的氮转化为对空气无污染的气体,该物质是________。
a.NaCl b.NH4Cl c.浓H2SO4
(4)氯碱工业通过电解饱和食盐水来获得相应的产物。请写出电解食盐水的离子方程式______________________________________,
若在标准状况下生成3.36 L H2,则溶液中生成的OH-的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为分别得到各含一种金属阳离子的沉淀物。可采取①通入H2S气体,②通入CO2气体,③加入盐酸,④加入氢氧化钠溶液四个步骤,每次通入或加入试剂均过量,且每次都把沉淀物滤出,其操作的正确顺序是( )。
| A.③①④② | B.①③④② | C.④②①③ | D.④②③① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com