

分析 由制备流程可知,明矾石脱水后,在焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2,得到的炉气主要为SO2,熟料中含K2SO4、Al2O3及少量的Fe2O3,然后加NaOH、H2O溶解时,发生Al2O3+2OH-=2AlO2-+H2O,废渣中含Fe2O3,溶液中含K2SO4、NaAlO2、Na2SO4,最后加硫酸条件pH,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4,以此来解答.
解答 解:由制备流程可知,明矾石脱水后,在焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2,得到的炉气主要为SO2,熟料中含K2SO4、Al2O3及少量的Fe2O3,然后加NaOH、H2O溶解时,发生Al2O3+2OH-=2AlO2-+H2O,废渣中含Fe2O3,溶液中含K2SO4、NaAlO2、Na2SO4,最后加硫酸条件pH,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4,
(1)反应中Al2(SO4)3→SO2,硫元素化合价由+6价降低为+4价,故Al2(SO4)3是氧化剂,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,生成1molAl2O3需要硫的物质的量为1mol×$\frac{3}{2}$=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024,
故答案为:Al2(SO4)3;3.612×1024;
(2)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)因含铁离子的溶液加KSCN溶液变为血红色可检验铁离子,选择HCl溶解固体,KSCN检验铁离子,则检验废渣中含有Fe2O3所需的试剂为HCl、KSCN,
故答案为:HCl、KSCN;溶液显血红色;
(4)由上述分析可知,加硫酸调pH值时,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4;沉淀洗涤干净则表面不含硫酸根离子,沉淀洗涤干净的实验操作和现象是取最后一次的洗涤液于试管中,加入BaCl2溶液,无白色沉淀产生,证明洗涤干净,
故答案为:K2SO4、Na2SO4;取最后一次的洗涤液于试管中,加入BaCl2溶液,无白色沉淀产生,证明洗涤干净.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应、混合物分离提纯方法为解答的关键,注意离子反应、氧化还原反应及离子检验的综合应用,侧重分析、实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaHSO4熔化时,离子键和共价键均被破坏 | |
| B. | 过氧化氢中只有非极性共价键 | |
| C. | 金属元素与非金属元素化合时,一定形成离子键 | |
| D. | 非金属元素也可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl具有很强的酸性,所以氯元素的非金属性很强 | |
| B. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质 | |
| C. | 1.12LCl2含有1.7NA个质子(NA 表示阿伏加德罗常数) | |
| D. | 氯气可从KI溶液中置换出I2,说明氯的非金属性比碘强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
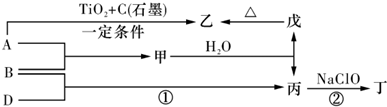
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
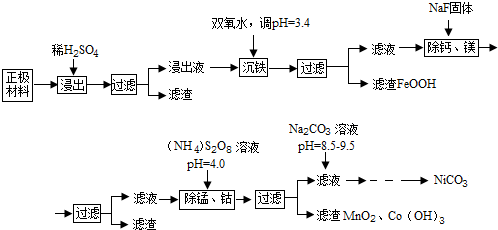
| 金属离子 | Ni2+ | Co2+ | Fe3+ | Mn2+ | Ca2+ | Mg2+ |
| 浓度(g/L) | 63.6 | 5.90 | 1.00 | 0.22 | 5.24×10-2 | 6.37×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物理量 编号 | V(0.20mol/L H2C2O4溶液)/mL | 甲 | V(O.O1mol/L KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 5.0 | |
| ② | 2.0 | 0 | 4.0 | 0 | 2.5 | |
| ③ | 1.0 | a | 4.0 | 0 | 2.5 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
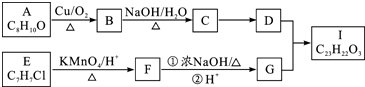
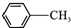 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$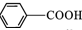

 .
.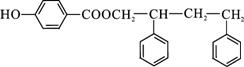 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂只有CuSO4 | |
| B. | SO42-既不是氧化产物也不是还原产物 | |
| C. | 1mol CuS04 还原了$\frac{1}{4}$mol S | |
| D. | 被还原的S和被氧化的S的质量比为7:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com