
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸的电离:CH3COOH═CH3COO-+H+ | |
| C. | 碳酸钙的溶解平衡:CaCO3(s)?Ca2+(aq)+CO32-(aq) | |
| D. | H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ/mol |
分析 A.NaHCO3水解呈碱性;
B.CH3COOH为弱电解质,不完全电离;
C.碳酸钙难溶于水,存在溶解平衡;
D.燃烧热指生成稳定的氧化物.
解答 解:A.NaHCO3水解呈碱性,应为HCO3-+H2O?OH-+H2CO3,故A错误;
B.CH3COOH为弱电解质,不完全电离,电离方程式为CH3COOH?CH3COO-+H+,故B错误;
C.碳酸钙难溶于水,存在溶解平衡,可表示为CaCO3(s)?Ca2+(aq)+CO32-(aq),故C正确;
D.燃烧热指生成稳定的氧化物,应生成液态水,热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ/mol,故D错误.
故选C.
点评 本题考查较为综合,涉及电解质的电离,盐类的水解、难溶电解质的溶解平衡以及热化学方程式的书写,为高频考点,侧重考查学生的分析能力以及双基的掌握,难度不大,注意基本理论知识的学习.


科目:高中化学 来源: 题型:选择题
| X | Y | Z |
| W | ||
| T |
| A. | W的氧化物对应水化物是强酸 | |
| B. | Z、W元素在自然界中均不能以游离态存在 | |
| C. | X、Y、Z元素的离子半径及它们的气态氢化物的热稳定性均依次递增 | |
| D. | 由元素周期律,可以推测T元素的单质具有半导体特性,T2Y3具有氧化性和还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84% | B. | 42% | C. | 53% | D. | 67% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
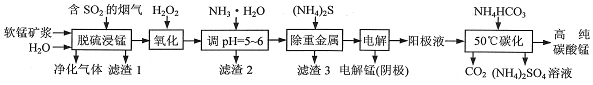
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CH4、氟氯代烃等都会造成温窒效应,因此都属于大气污染物 | |
| B. | 测定某地区的酸雨发现经过一段时间之后pH下降,判断为硝酸型酸雨 | |
| C. | 低碳经济主要与工厂、汽车排放有关,与人们用电、用水、用纸等是否节约无关 | |
| D. | 绿色化学的核心是利用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合气体中O2和CH4的体积比为2:1 | |
| B. | 残留物中只有Na2CO3和NaOH | |
| C. | 反应中电子转移总数为0.8NA | |
| D. | 残留物质量为26.6克 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com