
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为_____________________;
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
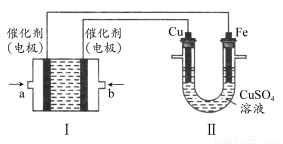
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是________;
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解);
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
(1)2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=-46 kJ·mol-1
(2)①CH4 O2+2H2O+4e-=4OH- ②变小 不变 ③CO32— ④0.56
【解析】(1)根据盖斯定律,将第一个热化学方程式乘以2,与第二个相加得2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=-46 kJ·mol-1。
(2)由于Fe棒上镀Cu,则Cu棒发生氧化反应,作阳极,b电极作正极,a电极作负极,CH4在a处通入,O2在b处通入,由于KOH作电解质溶液,则b极反应式为O2+2H2O+4e-=4OH-;电镀过程中电解质溶液不参与电极反应,各离子浓度均不变;CH4燃料电池中的化学方程式为CH4+2O2+2KOH=K2CO3+3H2O,可得溶液中存在CO32—,再由电子守恒得CH4~4Cu,则12.8 g Cu的物质的量为0.2 mol,消耗CH4为0.2/4=0.05 mol,在标准状况下的体积为0.05 mol×22.4 L·mol-1=0.56 L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届北京市怀柔区高二上学期期末质量检测化学试卷(解析版) 题型:选择题
下列实验式中,没有相对分子质量也可以确定分子式的是
A.CH3 B.CH2 C.CH D.C2H3
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:填空题
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl溶液与0.04 mol·L-1的NaHA溶液等体积混合
④0.02 mol·L-1的NaOH溶液与0.02 mol·L-1的NaHA溶液等体积混合
下列关于上述四种溶液的说法不正确的是( )
A.溶液②中存在水解平衡:HA-+H2O H2A+OH-
H2A+OH-
B.溶液③中有:c(HA-)+c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c(HA-)大小:③>①>②>④
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)  3C(g),若反应开始时充入2 mol A和1 mol B,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
3C(g),若反应开始时充入2 mol A和1 mol B,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
A.2 mol C
B.4 mol A、1 mol B
C.1 mol B和1 mol C
D.2 mol A、3 mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s 的平均速率v(PCl3)= 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0 mol Cl2,达到平衡时,PCl3 的转化率大于80%
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
下列反应中,Q2>Q1的是( )
A.H2(g)+F2(g)=2HF(g) ΔH=-Q1 kJ·mol-1
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-Q1 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 kJ·mol-1
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-Q1 kJ·mol-1
NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)ΔH=-Q2 kJ·mol-1
D.S(s)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1
S(g)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
下列过程都与热量变化有关,其中表述不正确的是( )
A. CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:选择题
A元素的阳离子与B元素的阴离子具有相同的电子层结构,关于两元素有以下叙述:①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A<B;⑤A的正化合价与B的负化合价的绝对值一定相等。其中正确的是 ( )
A.①② B.③④ C.③⑤ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:选择题
在新制的氯水中加入少量的碳酸钠粉末,下列说法正确的是( )
A.pH增大,HClO浓度增大 B.pH减小,Cl-浓度增大
C.pH增大,Cl-浓度减小 D.pH减小,HClO浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com